
Po poznanstvu Thomsonov atomski model, ki je menil, da so elektroni v pozitivno naelektrenem mediju, naprednejši model, znan kot Rutherfordov atomski model. Znanstvenik, zadolžen za ta novi napredek v znanosti, je bil Ernest Rutherford. Rodil se je 20. avgusta 1871 in umrl 19. oktobra 1937. V življenju je veliko prispeval k kemiji in svetu znanosti nasploh.
Zato bomo temu članku posvetili vse, kar morate vedeti o Rutherfordovem atomskem modelu.
Poskus z zlatimi listi
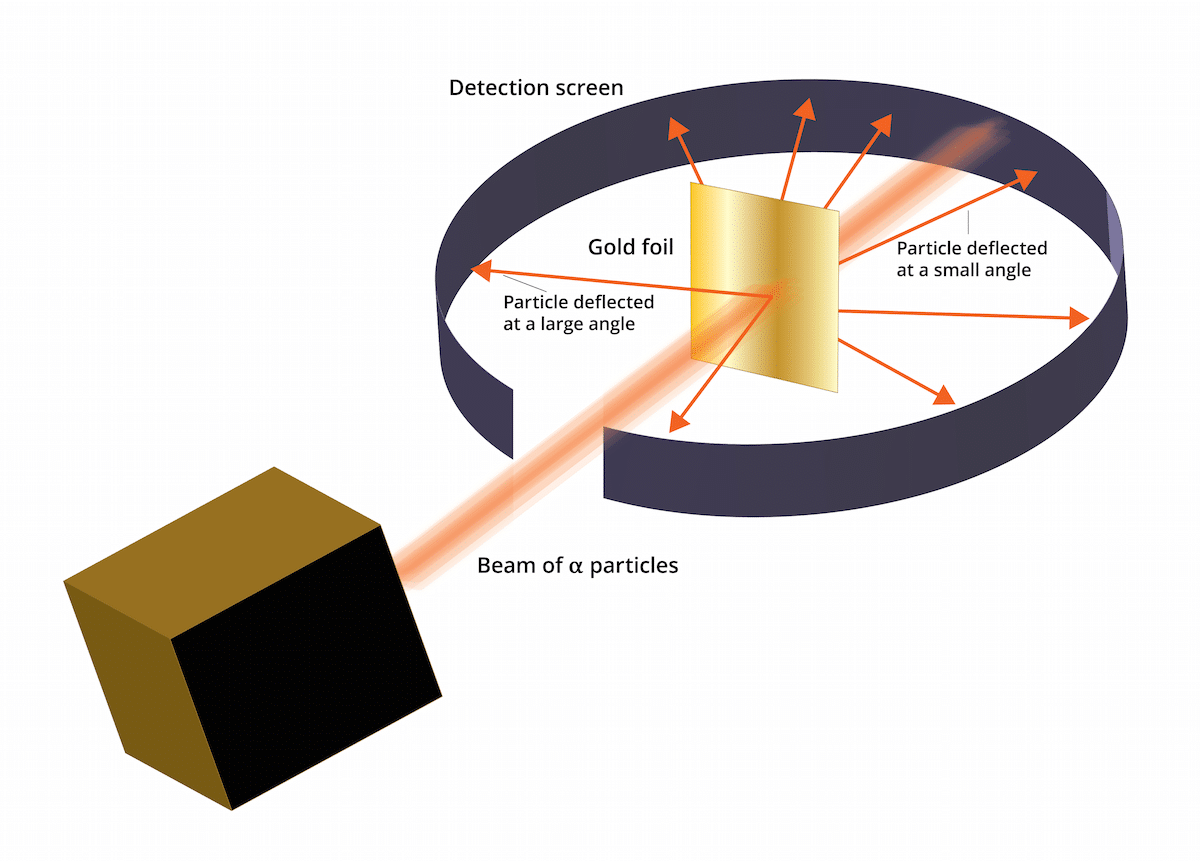
Stari model thomson je dejal, da so bili elektroni v pozitivno nabitih medijih. Leta 1909 je Ernest Rutherford v spremstvu dveh pomočnikov po imenu Geiger in Marsden naredil študijo, znano kot eksperiment z zlatim listom, kjer so lahko preverili, ali Znani Thomsonov "puding z rozinami" se je zmotil. In to je, da je ta novi poskus lahko pokazal, da ima atom strukturo z močnim pozitivnim nabojem. Ta poskus ali bi lahko pomagal obnoviti nekatere zaključke, ki so bili leta 1911 predstavljeni kot Rutherfordov atomski model.
Poskus, znan kot List zlata, ni bil edinstven, vendar so ga izvajali med letoma 1909 in 1913. Za to so ga uporabili fizikalni laboratoriji Univerze v Manchestru. Ti poskusi so bili zelo pomembni, saj je bilo mogoče iz njihovih rezultatov izpeljati nove zaključke, ki so privedli do revolucionarnega atomskega modela.
Ta poskus je vseboval naslednje: tanko pločevino zlata, debelo le 100 nm, je bilo treba zasipati z veliko količino alfa delcev. Ti alfa delci so bili in ioni. Se pravi atomi, ki nimajo elektronov, zato so imeli samo protone in nevtrone. Z nevtroni in protoni je bil skupni naboj atoma pozitiven. Cilj tega poskusa je bil predvsem potrditi, ali je model Thomson pravilen. Če je bil ta model pravi, alfa delci so morali skozi zlate atome v ravni črti.
Da bi preučili odklon, ki ga povzročajo delci alfa, je bilo treba okoli fine zlate folije namestiti fluorescentni filter cinkovega sulfida. Rezultat tega poskusa je bil, da je bilo mogoče opaziti, da so nekateri delci lahko prehajali skozi zlate atome pločevine v ravni črti. Vendar so bili nekateri od teh delcev alfa odklonjeni v naključnih smereh.
Zaključki poskusa z zlatimi listi

Glede na to dejstvo ni bilo mogoče potrditi, kaj se šteje za prejšnje atomske modele. In to je, da so ti atomski modeli poudarili, da je bil pozitivni naboj enakomerno porazdeljen v atomih in bi ga bilo lažje prečkati, saj njegov naboj v določeni točki ne bi bil tako močan.
Rezultati tega poskusa z zlatimi listi so bili popolnoma nepričakovani. Zaradi tega je Rutherford pomislil, da ima atom središče z močnim pozitivnim nabojem, ki nastane, ko je delček alfa poskusite razglasiti, da ga je zavrnila osrednja struktura. Da bi ugotovili zanesljivejši vir, so bili delci upoštevani v količinah tistih, ki so se odražali, in tistih, ki jih niso. Zahvaljujoč tej izbiri delcev je bilo mogoče določiti velikost jedra v primerjavi z orbito elektronov, ki so okoli njega. Lahko bi tudi sklepali, da je večina prostora atoma prazna.
Videlo se je, da je nekaj delcev alfa odklonila zlata folija. Nekateri so odstopali le pod zelo majhnimi koti. To je pomagalo sklepati, da pozitivni naboj na atomu ni enakomerno porazdeljen. To pomeni, da se pozitivni naboj nahaja na atomu koncentrirano v zelo majhnem prostoru.
Zelo malo alfa delcev se je odneslo nazaj. To odstopanje kaže, da bi se delci lahko vrnili. Zahvaljujoč vsem tem novim premislekom bi lahko Rutherfordov atomski model vzpostavili z novimi idejami.
Rutherfordov atomski model

Preučevali bomo, katera so načela Rutherfordovega atomskega modela:
- Delci, ki imajo v atomu pozitiven naboj razporejeni so v zelo majhni prostornini, če jo primerjamo s celotno prostornino omenjenega atoma.
- Skoraj vsa masa atoma je v omenjenem majhnem volumnu. Ta notranja masa se je imenovala jedro.
- Elektroni, ki imajo negativne naboje najdemo, da se vrtijo okoli jedra.
- Elektroni se vrtijo z veliko hitrostjo, ko so okoli jedra, in to po krožnih poteh. Te poti smo imenovali orbite. Kasneje bom znani so kot orbitale.
- Tako elektroni, ki so bili negativno nabiti, kot jedro pozitivno nabitoga atoma, so vedno zadržani skupaj zaradi elektrostatične privlačne sile.
Sprejemanje in omejitve Rutherfordovega atomskega modela
Kot je bilo pričakovano, je ta novi model predstavljal povsem novo panoramo atoma v znanstvenem svetu. Zahvaljujoč temu atomskemu modelu so lahko številni kasnejši znanstveniki preučevali in določali število elektronov, ki jih ima vsak element v periodnem sistemu. Poleg tega bi lahko prišli do novih odkritij, ki pomagajo na najpreprostejši način razložiti delovanje atoma.
Vendar ima ta model tudi nekatere omejitve in napake. Čeprav je šlo za preboj v svet fizike, niso bili niti popoln niti popoln model. In ali je to od v skladu z Newtonovimi zakoni in pomembnim vidikom Maxwellovih zakonov, ta model ni mogel razložiti nekaterih stvari:
- Ni si mogel razložiti, kako so se negativni naboji lahko držali skupaj v jedru. Glede na elektronsko golenico se morajo pozitivni naboji med seboj odbijati.
- Drugo protislovje je bilo do temeljnih zakonov elektrodinamike. Če naj bi se elektroni s pozitivnim nabojem vrteli okoli jedra, bi morali oddajati elektromagnetno sevanje. Z oddajanjem tega sevanja se porabi energija, da se elektroni v jedru sesedejo. Zato progasti atomski model ne more razložiti stabilnosti atoma.
Upam, da boste s temi informacijami izvedeli več o Rutherfordovem atomskem modelu.