
Po zoznámení Thomsonov atómový model, ktorá považovala elektróny za kladne nabité médium, pokročilejší model známy ako Rutherfordov atómový model. Vedcom zodpovedným za tento nový pokrok v oblasti vedy bol Ernest Rutherford. Narodil sa 20. augusta 1871 a zomrel 19. októbra 1937. Počas svojho života významne prispel k chémii a všeobecne k svetu vedy.
Preto sa budeme venovať tomuto článku, aby sme vám povedali všetko, čo potrebujete vedieť o Rutherfordovom atómovom modeli.
Experiment so zlatými listami
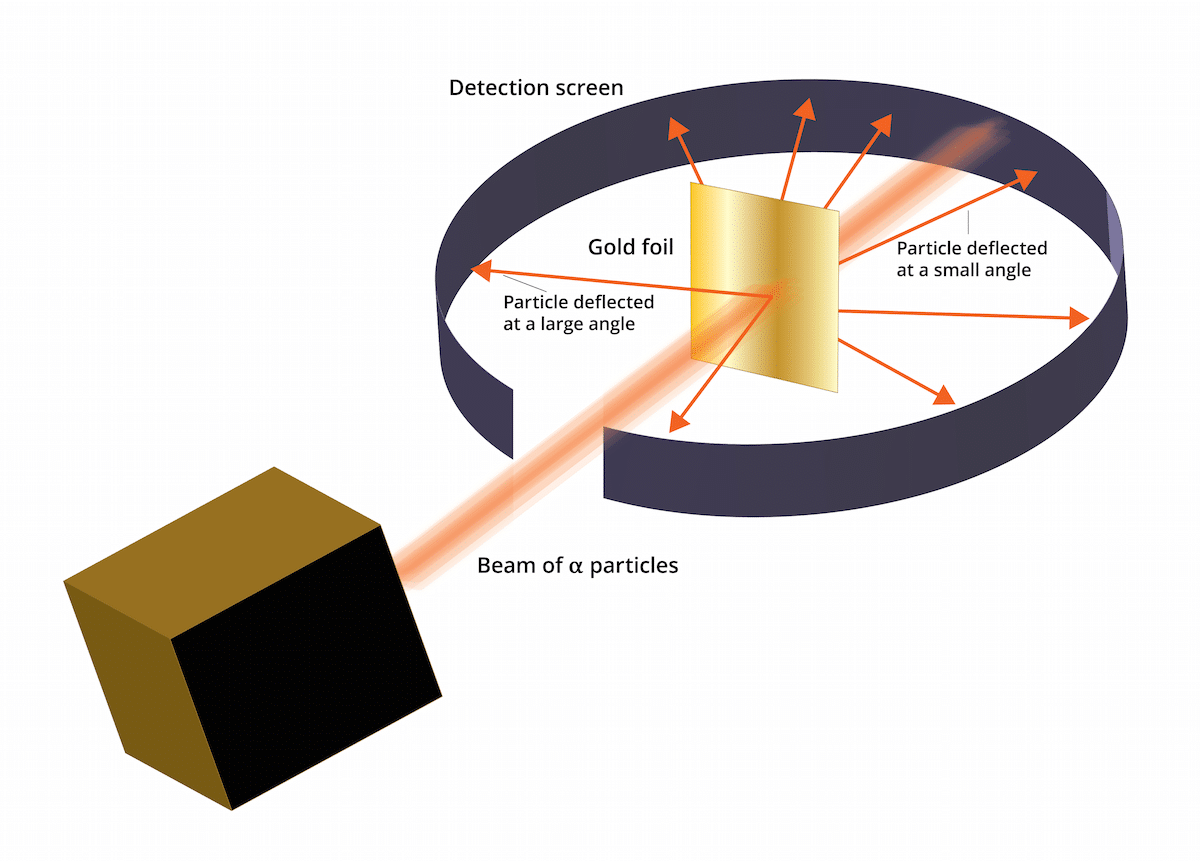
Starý Thomsonov model uviedol, že elektróny boli v kladne nabitom prostredí. V roku 1909 vypracoval Ernest Rutherford v sprievode dvoch asistentov menom Geiger a Marsden štúdiu známu ako experiment so zlatými listami, kde boli schopní overiť, že Známy Thomsonov „hrozienkový puding“ sa mýlil. Tento nový experiment dokázal, že atóm mal štruktúru so silným kladným nábojom. Tento experiment alebo mohol pomôcť obnoviť niektoré závery, ktoré sa nakoniec v roku 1911 predstavili ako Rutherfordov atómový model.
Experiment známy ako Leaf of Gold nebol jedinečný, ale uskutočnili sa v rokoch 1909 až 1913. Použili na to svoj účel fyzikálne laboratóriá na univerzite v Manchestri. Tieto experimenty mali veľký význam, pretože z ich výsledkov bolo možné vyvodiť nové závery, ktoré viedli k revolučnému atómovému modelu.
Tento experiment spočíval v nasledujúcom: tenký plát zlata hrubý iba 100 nm musel byť bombardovaný veľkým množstvom alfa častíc. Tieto alfa častice boli a ióny. Teda atómy, ktoré nemajú elektróny, takže mali iba protóny a neutróny. Tým, že mal neutróny a protóny, bol celkový náboj atómu pozitívny. Cieľom tohto experimentu bolo hlavne potvrdiť, či je Thomsonov model správny. Keby mal tento model pravdu, častice alfa museli prechádzať cez atómy zlata priamo.
Aby bolo možné študovať vychýlenie spôsobené časticami alfa, musel byť okolo fólie z jemného zlata umiestnený fluorescenčný filter na báze sulfidu zinočnatého. Výsledkom tohto experimentu je, že sa pozorovalo, že niektoré častice boli schopné prechádzať cez atómy zlata plechu v priamke. Niektoré z týchto alfa častíc však boli odklonené v náhodných smeroch.
Závery experimentu so zlatými listami

Vzhľadom na túto skutočnosť nebolo možné potvrdiť, za čo sa považujú predchádzajúce atómové modely. A to je to, že tieto atómové modely poukazovali na to, že kladný náboj bol v atómoch distribuovaný rovnomerne, čo by uľahčilo jeho prekročenie, pretože jeho náboj by v určitom okamihu nebol taký silný.
Výsledky tohto experimentu so zlatými listami boli úplne neočakávané. Toto prinútilo Rutherforda myslieť si, že atóm mal centrum so silným kladným nábojom, ktoré tvorilo, keď bola častica alfa skúste to rozdať odmietnuté centrálnou štruktúrou. S cieľom nájsť spoľahlivejší zdroj sa častice brali do úvahy v množstvách tých, ktoré sa odrazili, a tých, ktoré sa odrážali. Vďaka tomuto výberu častíc bolo možné určiť veľkosť jadra v porovnaní s obežnou dráhou elektrónov, ktoré sú okolo neho. Dalo by sa tiež dospieť k záveru, že väčšina priestoru atómu je prázdna.
Bolo vidieť, že niektoré alfa častice boli vychýlené zlatou fóliou. Niektoré z nich sa odchýlili iba vo veľmi malých uhloch. To pomohlo dospieť k záveru, že kladný náboj na atóme nie je rovnomerne rozložený. To znamená, že kladný náboj je umiestnený na atóme koncentrovaným spôsobom vo veľmi malom objeme priestoru.
Veľmi málo alfa častíc sa posunulo späť. Táto odchýlka naznačuje, že častice sa mohli odraziť späť. Vďaka všetkým týmto novým úvahám mohol byť Rutherfordov atómový model založený na nových nápadoch.
Rutherfordov atómový model

Budeme študovať, aké sú princípy Rutherfordovho atómového modelu:
- Častice, ktoré majú vo vnútri atómu kladný náboj sú usporiadané vo veľmi malom objeme, ak to porovnáme s celkovým objemom uvedeného atómu.
- Takmer všetka hmotnosť, ktorú atóm má, je v uvedenom malom objeme. Táto vnútorná hmota sa nazývala jadro.
- Elektróny, ktoré majú záporné náboje sa nachádzajú rotujúce okolo jadra.
- Elektróny sa otáčajú vysokou rýchlosťou, keď sú okolo jadra, a rotujú to po kruhových dráhach. Tieto trajektórie sa nazývali obežné dráhy. Neskôr budem sú známe ako orbitály.
- Obidva elektróny, ktoré boli negatívne nabité, a jadro kladne nabitého atómu sú vďaka elektrostatickej príťažlivej sile vždy držané pohromade.
Prijatie a obmedzenia Rutherfordovho atómového modelu
Podľa očakávania tento nový model predstavoval úplne novú panorámu atómu vo vedeckom svete. Vďaka tomuto atómovému modelu mohlo mnoho neskorších vedcov študovať a určiť počet elektrónov, ktoré má každý prvok v periodickej tabuľke. Okrem toho by bolo možné urobiť nové objavy, ktoré pomôžu vysvetliť fungovanie atómu najjednoduchším spôsobom.
Tento model má však aj určité obmedzenia a chyby. Aj keď išlo o prielom vo svete fyziky, neboli dokonalým ani úplným modelom. A je to z podľa Newtonových zákonov a dôležitého aspektu Maxwellových zákonov, tento model nedokázal vysvetliť určité veci:
- Nevedel vysvetliť, ako sú negatívne náboje schopné držať spolu v jadre. Podľa elektronickej holennej kosti sa kladné náboje musia navzájom odpudzovať.
- Ďalším rozporom bol základný zákon elektrodynamiky. Ak by sa elektróny s kladným nábojom považovali za rotujúce okolo jadra, mali by emitovať elektromagnetické žiarenie. Vyžarovaním tohto žiarenia sa spotrebuje energia na to, aby sa elektróny zrútili v jadre. Preto pruhovaný atómový model nemôže vysvetliť stabilitu atómu.
Dúfam, že s týmito informáciami sa dozviete viac o Rutherfordovom atómovom modeli.