Skupina hydroxyl Je to ten, ktorý sa skladá z atómu kyslíka a atómu vodíka a pripomína molekulu vody. Nájdeme ho v rôznych chemických formách, napríklad v skupine, ióne alebo radikáli. Pre všetkých ľudí, ktorí študujú organickú chémiu, je poznanie reakcií a dôležitosti tejto skupiny atómov zásadné. Je schopný vytvárať základné väzby s atómom uhlíka, aj keď je to možné aj so sírou a fosforom.
V tomto článku vám povieme o vlastnostiach hydroxylovej skupiny a jej dôležitosti v organickej chémii.
kľúčové vlastnosti
Keď analyzujeme hydroxylovú skupinu z hľadiska anorganickej chémie, zistíme, že sa zúčastňuje skôr ako ión. Inými slovami, druh čipky, ktorý existuje medzi ním a kovmi, nie je kovalentný, ale iónový. Z tohto dôvodu sa hydroxylová skupina stala dôležitým prvkom, ktorý pomáha definovať vlastnosti a transformácie mnohých zlúčenín.
Hydroxylová skupina je pripojená k zvyšku, ktorý je definovaný cs písmenom R, ak je to alkyl, alebo s písmenom Ar, ak je aromatický. O vede viem najviac to, čo prispieva hydroxylovou skupinou k molekule, na ktorú sa viaže. Najlepšiu odpoveď nájdeme v štúdiu jeho protónov. A je to, že protóny môžu byť zachytené silnými bázami za vzniku solí. To môže tiež interagovať s ostatnými okolitými skupinami, ktoré sú navzájom spojené vodíkovými väzbami. Najdôležitejšie na hydroxylovej skupine je navyše to, že nech je kdekoľvek, môže predstavovať potenciálnu oblasť pre tvorbu vody.
Štruktúra hydroxylovej skupiny

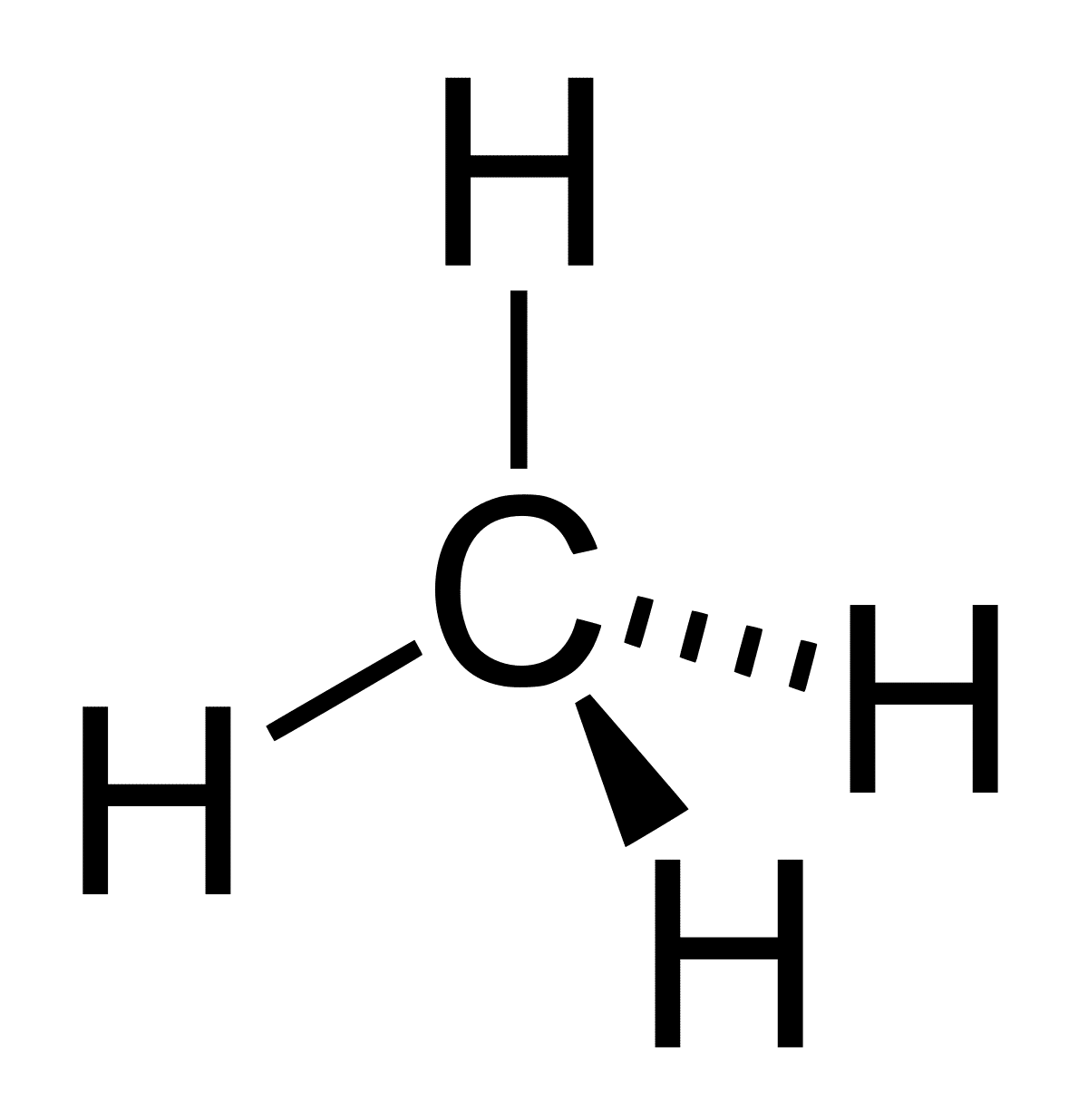
Hydroxylová skupina sa stala celkom zaujímavou molekulou z hľadiska organickej chémie. Molekula vody má hranatý tvar a vyzerá ako bumerang. Ak prestrihneme jeden z jeho koncov, čo znamená to isté ako odstránenie protónu, môžu nastať rôzne situácie. Molekula vody je transformované na hydroxylový radikál alebo hydroxylový ión. Oba však majú molekulárnu lineárnu geometriu a nie sú elektronické.
Všetky tieto väzby sú spôsobené skutočnosťou, že sú orientované na dva atómy, aby mohli zostať vždy zarovnané. To isté neplatí pre hybridné orbitály. Kľúčom k tomu, aby hydroxylová skupina umožňovala zmiešanie rôznych molekúl navzájom, sú potrebné vodíkové väzby. Tieto vodíkové väzby nie sú samy o sebe silné, ale so zvyšujúcim sa počtom zdrojov a počtom hydroxylových skupín v štruktúre sa účinky znásobujú. Toto zvýšenie počtu vodíkových väzieb sa odráža aj vo fyzikálnych vlastnostiach zlúčeniny.
Vodíkové väzby vyžadujú, aby boli atómy oproti sebe. Existuje niekoľko atómov kyslíka jednej hydroxylovej skupiny, ktoré musia byť usporiadané tak, aby mohla vytvárať priamu čiaru s vodíkom druhej skupiny. Je to o niečo zložitejšie, ale stáva sa to často. Takto vznikajú celkom konkrétne priestorové usporiadania ako napr čo sa deje v štruktúre molekuly DNA. To sa deje medzi dusíkatými bázami, ktoré tvoria DNA.
Počet hydroxylových skupín môžeme nazvať štruktúrou priamo úmernou afinite vody k molekule. Uvedieme príklad, aby sme tomu lepšie porozumeli. Aj keď má cukor hydrofóbnu uhlíkovú štruktúru, pretože má veľké množstvo hydroxylových skupín, je veľmi dobre rozpustný vo vode.
Ióny a ich funkcie
Hydroxylová skupina a ión sú si veľmi podobné, ale majú odlišné chemické vlastnosti. Hydroxylový ión je mimoriadne silná báza a funguje tak, že zachytáva protóny. Ak to nasilu vynútime, môže sa zmeniť na vodu. A toto je neúplná molekula vody, ktorá je negatívne nabitá a na dokončenie potrebuje protón. Na druhej strane od hydroxylovej skupiny na dokončenie nepotrebuje zachytávať protóny, správa sa ako extrémne slabá základňa. Je schopný darovať protóny, aj keď to robí iba proti veľmi silným základniam.
Pozitívne jadrá sú atómy v molekule, ktoré trpia elektronickým nedostatkom v dôsledku svojho elektronegatívneho prostredia.
Hydroxylová skupina a meteorológia

Vieme, že vo vzduchu funguje ako druh čistiaceho prostriedku, ktorý štiepi ďalšie plyny. Vieme, že hydroxylová skupina je hlavnou reguláciou koncentrácie metánu. Plynný metán je skleníkový plyn, ktorý je prekonaný iba v koncentrácii oxidu uhličitého ako príspevku k globálnemu otepľovaniu. Aj keď sa metán v atmosfére nachádza v menšej miere, je schopný zadržať väčšie množstvo tepla ako oxid uhličitý.
Existuje nový výskum vedený postdoktorandom NASA, ktorý ukázal, že hydroxylové radikály sa recyklujú samy a sú schopné udržiavať konštantnú atmosférickú koncentráciu. Táto koncentrácia sa v priebehu času udržuje, aj keď sa zvyšujú emisie metánu. Preto je pochopenie úlohy hydroxylu nevyhnutné na pochopenie doby použiteľnosti metánu a atmosféry.
Vedci poukázali na to, že zvyšovanie koncentrácií a emisií plynného metánu by mohlo spôsobiť zníženie množstva hydroxylových radikálov v globálnom meradle. Týmto spôsobom by sa predĺžila životnosť metánu, čo by bol problém, ktorý by prispel ku globálnemu otepľovaniu. Predĺžením životnosti metánu by sme nemali čím vyčistiť atmosféru. Boli pozorované primárne zdroje hydroxylu a metánu a ich reakcia. K recyklácii tejto skupiny dochádza potom, čo sa metán rozpadne a potom sa reformuje v prítomnosti ďalších plynov. Koncentrácie hydroxylu sú v priebehu času pomerne stabilné. Nemusia nevyhnutne zmiznúť, keď reaguje s metánom.
Dúfam, že s týmito informáciami sa dozviete viac o hydroxylovej skupine a jej dôležitosti.