
La Legea lui Boyle a fost descoperit de Robert Boyle în secolul al XVII-lea și a pus bazele pentru a explica relația dintre presiune și volum prezent în gaze. Printr-o serie de experimente, a reușit să demonstreze că, dacă temperatura este constantă, un gaz își reduce volumul atunci când este supus unei presiuni mai mari, iar volumul crește dacă presiunea este redusă.
În acest articol vă vom spune tot ce trebuie să știți despre legea lui Boyle, caracteristicile și importanța acesteia.
caracteristici cheie
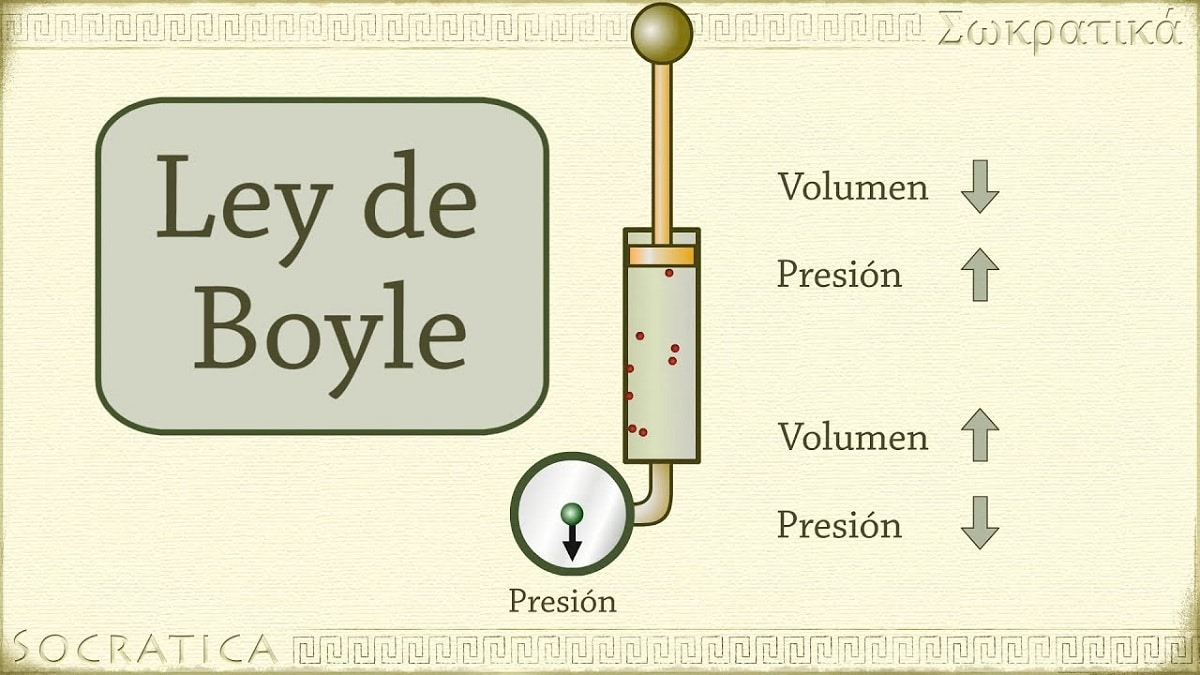
În 1662, Robert Boyle a descoperit că presiunea exercitată asupra unui gaz este invers proporțională cu volumul și numărul de moli ai acestuia la temperatură constantă. Cu alte cuvinte, dacă presiunea aplicată unui gaz este dublată, același gaz va fi comprimat și volumul acestuia se va înjumătăți.
Pe măsură ce volumul recipientului care conține gazul crește, crește și distanța pe care particulele trebuie să parcurgă înainte de a se ciocni cu pereții containerului. Această creștere a distanței permite scăderea frecvenței șocurilor, astfel încât presiunea pe perete este mai mică decât înainte când volumul era mai mic.
Legea lui Boyle a fost descoperită pentru prima dată în 1662 de Robert Boyle. Edme Mariotte a fost un alt om de știință care a gândit și a ajuns la aceleași concluzii ca și Boyle, cu toate acestea, Mariotte nu și-a făcut publică opera până în 1676. De aceea, în multe cărți găsim această lege numită Legea lui Boyle și Legea lui Mariot Legea lui Boyle-Mariot, cunoscută și sub numele de Legea lui Mattut, elaborată de fizicianul și chimistul britanic Robert A fost formulată independent de Boyle și de fizicianul și botanistul francez Edmé Mattout.
Se referă la una dintre legile care leagă volumul și presiunea unui gaz cu o anumită cantitate de gaz menținută la o temperatură constantă. Legea lui Boyle afirmă următoarele: Presiunea exercitată de o forță este fizic invers proporțională cu volumul materiei gazoase atâta timp cât temperatura acesteia rămâne constantă. Sau mai simplu, îl putem interpreta astfel: la o temperatură constantă mai mare, volumul unei mase fixe de gaz este invers proporțional cu presiunea constantă pe care o exercită.
Experimente și aplicații ale legii lui Boyle

Pentru a demonstra teoria Legii lui Boyle, Mariot a fost responsabil cu introducerea gazului într-un cilindru cu piston și a putut verifica diferitele presiuni care au fost create pe măsură ce pistonul cobora. Din acest experiment se deduce că pe măsură ce volumul crește, presiunea scade.
Legea lui Boyle are multe aplicații în viața modernă, printre care putem aminti de exemplu scufundări, asta pentru că scafandrul trebuie să expulzeze aerul din plămâni la ascensiune deoarece acesta se dilată când presiunea scade, dacă nu face acest lucru poate cauza leziuni tisulare.
Se găsește în toate echipamentele care utilizează sau sunt alimentate cu energie pneumatică, cum ar fi brațele robotizate care utilizează componente precum pistoanele pneumatice, actuatoarele, regulatoarele de presiune și supapele de limitare a presiunii.
Motoarele pe benzină, pe gaz sau diesel folosesc legea lui Boyle și în timpul arderii interne, deoarece prima dată aer intră în cilindru cu volum și presiune, a doua oară reduce volumul prin creșterea presiunii.
Mașinile au sisteme de airbag care funcționează prin expulzarea unei anumite cantități de aer sau gaz dintr-o cameră care ajunge în airbagul exterior, unde presiunea scade și volumul crește menținând o temperatură constantă.
Legea lui Boyle este foarte importantă astăzi pentru că este legea care ne vorbește și explică comportamentul gazelor. Cu siguranță explică faptul că presiunea și volumul unui gaz sunt invers proporționale între ele. Prin urmare, atunci când se aplică presiune unui gaz, volumul acestuia scade și presiunea crește.
model de gaz ideal

Legea Boyle-Mariotte se aplică așa-numitelor gaze ideale, un model teoretic care simplifică foarte mult comportamentul oricărui gaz, presupunând:
- molecule de gaz sunt atât de mici încât nu este necesar să ne gândim la mărimea lor, mai ales având în vedere că aceasta este mult mai mică decât distanța pe care o parcurg.
- În plus, moleculele abia interacționează, cu excepția cazului în care se ciocnesc foarte scurt și când o fac, ciocnirea este elastică, astfel încât atât impulsul, cât și energia cinetică sunt conservate.
- În cele din urmă, să presupunem că această energie cinetică este proporțională cu temperatura probei gazoase, adică cu cât particulele sunt mai agitate, cu atât temperatura este mai mare.
Gazele ușoare, indiferent de identitatea lor, urmează aceste linii directoare foarte strict în condiții standard de temperatură și presiune (adică: 0ºC și presiunea atmosferică (1 atmosferă). Pentru aceste gaze, legea Boyle-Mariotte descrie comportamentul lor foarte precis. .
Deoarece P∙V este constant la o anumită temperatură, dacă presiunea gazului se modifică, volumul se modifică astfel încât produsul rămâne același, deci în două stări diferite 1 și 2, egalitatea poate fi exprimată după cum urmează:
P1∙V1 = P2∙V2
Apoi cunoscând o stare, plus o variabilă din cealaltă stare, puteți cunoaște variabila lipsă eliminând-o din legea Boyle-Mariot.
Istoria legii lui Boyle
chimist britanic. Pionier al experimentelor în domeniul chimiei, în special în proprietățile gazelor,
Teza lui Robert Boyle despre comportamentul materiei la nivel de particule a fost un precursor al teoriei moderne a elementelor chimice. De asemenea, a fost membru fondator al Societății Regale din Londra.
Robert Boyle s-a născut într-o familie nobilă din Irlanda și a urmat cele mai bune școli englezești și europene. Din 1656 până în 1668, a fost asistentul lui Robert Hooke la Universitatea Oxford, colaborând cu el la o serie de experimente care au determinat proprietățile fizice ale aerului și modul în care acesta arde, respiră și transmite sunetul.
Rezultatele acestor contribuții au fost colectate în lor „Noi experimente fizico-mecanice privind elasticitatea aerului și efectele acestuia» (1660). În a doua ediție a acestei lucrări (1662), el dezvăluie celebra proprietate a gazelor, legea Boyle-Mariotte, care afirma că volumul ocupat de un gaz la temperatură constantă este invers proporțional cu presiunea acestuia. Astăzi se știe că această lege este îndeplinită numai atunci când este acceptată comportamentul ideal teoretic al gazelor.
Sper că cu aceste informații puteți afla mai multe despre legea lui Boyle, caracteristicile și aplicațiile ei în lumea științei.