
El átomo es la unidad básica de la materia y es la fracción más pequeña que puede identificar un elemento químico. Consiste en un núcleo atómico que contiene neutrones y protones, y electrones que rodean el núcleo. El término átomo se deriva del griego y significa indivisible. Sin embargo, muchas personas no saben bien qué es un átomo ni cuáles son sus características.
Por ello, vamos a dedicar este artículo a contarte qué es un átomo, sus características e importancia.
Qué es un átomo

Los átomos constan de una parte central llamada núcleo, en la que residen los protones (partículas cargadas positivamente) y los neutrones (partículas eléctricamente neutras). La región alrededor del núcleo está ocupada por electrones (partículas cargadas negativamente); esta región se llama capa eléctrica. La capa eléctrica (cargada negativamente) y el núcleo (cargado positivamente) se mantienen unidos por atracción eléctrica.
El diámetro medio de un átomo es de unos 10-10 metros, y el diámetro medio de un núcleo es de unos 10-15 metros; por tanto, un átomo tiene un diámetro de 10.000 a 100.000 veces mayor que su núcleo. Por ejemplo, si un átomo tiene el tamaño de un campo de fútbol, el núcleo tendrá el mismo tamaño que la pelota en el centro del campo. Si un átomo tiene 100 metros de diámetro, su núcleo tiene 1 centímetro de diámetro.
Algo de historia

El filósofo griego Aristóteles (384 a. C. – 322 a. C.) intentó explicar la composición de toda la materia a partir de los elementos: tierra, aire, fuego y agua. Demócrito (546 a. C. – 460 a. C.) fue un científico y matemático griego que propuso la idea de que había un límite para el tamaño de las partículas. Estas partículas se vuelven tan pequeñas que ya no pueden dividirse, dijo. Llamó a tales partículas «átomos».
Durante la mayor parte del siglo XIX, fue el modelo atómico del científico británico Dalton quien propuso la teoría atómica, que estaba mucho más allá del pensamiento de los antiguos en ese momento.
Esta teoría dice que toda la materia está formada por pequeñas partículas indivisibles llamadas átomos. Investigaciones recientes han encontrado que los átomos están formados por otras partículas pequeñas llamadas partículas subatómicas.
Históricamente se han desarrollado diferentes teorías atómicas sobre la composición de la materia antes de que se obtuviera el conocimiento actual sobre la estructura atómica. Con base en la teoría atómica, los científicos han estado demostrando modelos de átomos que evolucionan gradualmente.
El primer modelo propuesto por John Dalton se desarrolló hasta llegar al modelo del átomo de Niels Bohr. Bohr propuso un modelo muy similar al modelo actual de electrones que orbitan alrededor del núcleo.
Estructura de un átomo
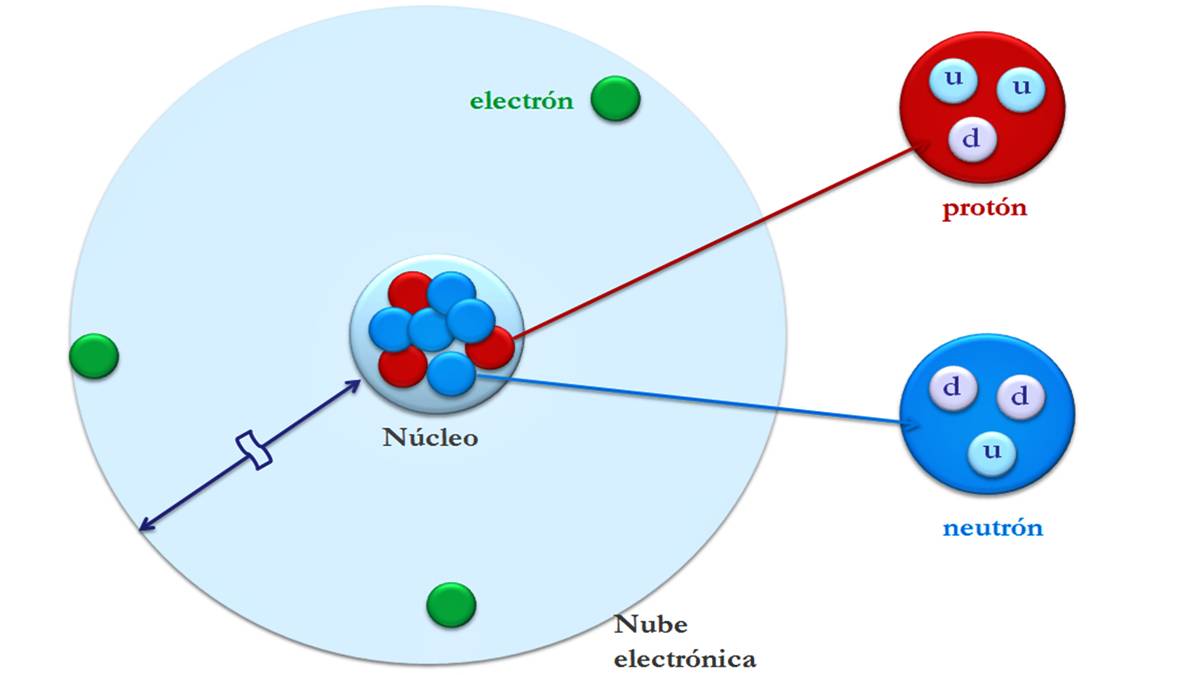
Los átomos están formados por partículas diminutas llamadas partículas subatómicas: electrones, protones y neutrones. La mayor parte de la masa de un átomo se concentra en el núcleo. Y su mayor volumen está en la capa eléctrica donde se encuentran los electrones.
Electrones, protones y neutrones
Los electrones tienen carga negativa y casi no tienen masa. Su masa es unas 1840 veces la del núcleo atómico. Son diminutas partículas que giran alrededor del núcleo central de un átomo. Además, se mueven rápidamente alrededor del núcleo generando un campo electromagnético.
Un protón tiene la misma carga positiva que la carga de un electrón en valor absoluto, por lo que los protones y los electrones tienden a atraerse entre sí. Estos constituyen la unidad de masa y junto con los neutrones forman el núcleo del átomo.
Los neutrones no tienen carga, es decir, tienen carga neutra. Junto con los protones, forma el núcleo y representa casi toda la masa (99,9%) del átomo. Los neutrones proporcionan estabilidad al núcleo.
Los átomos tienen niveles de energía, siete capas alrededor del núcleo en las que hay electrones que orbitan alrededor del núcleo. Las capas se denominan K, L, M, N, O, P y Q. Cada capa puede contener un número finito de electrones: ocho electrones por capa. La capa más externa es siempre la más dinámica. Solo el átomo de hidrógeno no tiene neutrones y solo un electrón orbita alrededor del protón.
Características químicos
En química, los átomos son las unidades fundamentales que suelen conservar sus propiedades originales en cada reacción. No se destruyen ni se crean, simplemente se organizan de diferentes maneras con diferentes conexiones entre ellos.
Los átomos se agrupan para crear moléculas y otros tipos de materiales. Los enlaces creados en las reacciones químicas tienen una determinada composición que distingue a los diferentes elementos químicos. Estos elementos son los que aparecen en la tabla periódica de elementos.
Cada uno de estos elementos tiene muchos protones en el núcleo. Este número se llama número atómico y se denota con la letra Z. Todos los átomos con el mismo número de protones pertenecen al mismo elemento y tienen las mismas propiedades químicas aunque sean elementos químicos diferentes.
Por otro lado, encontramos el número de masa, denotado por la letra A. Este número se refiere al número de nucleones presentes en el átomo. Otro tipo de átomo que podemos encontrar, y del que mejor conocemos, es un isótopo. Estos átomos tienen el mismo número de protones pero diferente número de neutrones. Tienen las mismas propiedades químicas aunque sus propiedades físicas son diferentes entre sí.
Como señalamos antes, los isótopos son muy importantes. Y son vitales para la energía nuclear porque el enriquecimiento de uranio implica convertir un isótopo de uranio en otro con una estructura química más inestable, lo que nos permite tener una reacción en cadena.
Propiedades
Las propiedades que definen a un átomo son:
- Número atómico (Z) que indica el número de protones en el núcleo. Todos los átomos con el mismo número de protones pertenecen al mismo elemento. Por ejemplo, un átomo de hidrógeno con un solo protón.
- El número de masa se refiere a la suma de protones y neutrones. Los elementos con diferente número de neutrones son diferentes isótopos del mismo elemento.
- La electronegatividad es la tendencia de los átomos a atraer electrones cuando forman enlaces químicos.
- El radio atómico corresponde a la mitad de la distancia entre dos núcleos del mismo elemento unidos.
- El potencial de ionización es la energía necesaria para separar un electrón de un elemento.
Espero que con esta información puedan conocer más sobre qué es un átomo y sus características.
MUY BUENO
RICARDO