
La Lei de Boyle foi descoberto por Robert Boyle no século XVII e lançou as bases para explicar a relação entre pressão e volume presente nos gases. Através de uma série de experimentos, ele conseguiu mostrar que, se a temperatura for constante, um gás reduz seu volume quando submetido a mais pressão e aumenta de volume se a pressão for reduzida.
Neste artigo vamos contar tudo o que você precisa saber sobre a lei de Boyle, suas características e importância.
Características principais
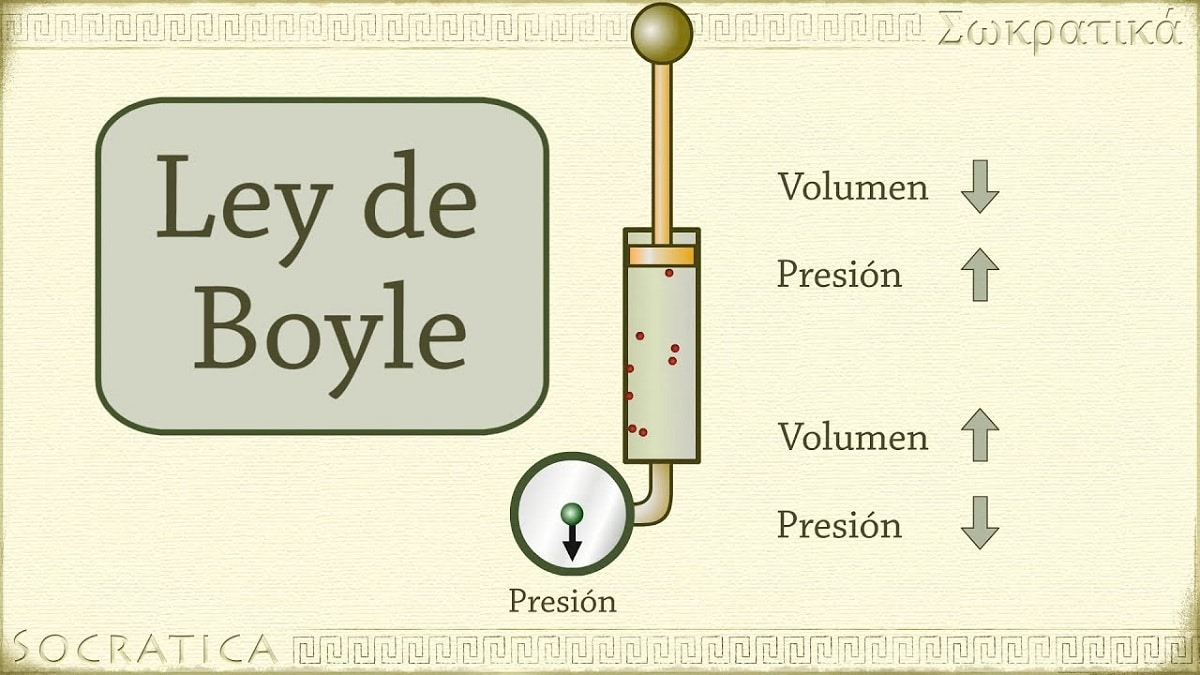
Em 1662, Robert Boyle descobriu que a pressão exercida sobre um gás é inversamente proporcional ao seu volume e número de moles a temperatura constante. Em outras palavras, se a pressão aplicada a um gás for dobrada, o mesmo gás será comprimido e seu volume será reduzido pela metade.
À medida que o volume do recipiente contendo o gás aumenta, a distância que as partículas devem percorrer antes de colidir com as paredes do recipiente também aumenta. Esse aumento na distância permite que a frequência dos choques diminua, de modo que a pressão na parede é menor do que antes quando o volume era menor.
A Lei de Boyle foi descoberta pela primeira vez em 1662 por Robert Boyle. Edme Mariotte foi outro cientista que pensou e chegou às mesmas conclusões que Boyle, no entanto, Mariotte não tornou seu trabalho público até 1676. É por isso que em muitos livros encontramos essa lei chamada Lei de Boyle e Mariot Lei de Boyle-Mariot, também conhecida como Lei de Mattut, desenvolvida pelo físico e químico britânico Robert Foi formulada independentemente por Boyle e pelo físico e botânico francês Edmé Mattout.
Refere-se a uma das leis que relacionam o volume e a pressão de um gás a uma certa quantidade de gás mantida a uma temperatura constante. A Lei de Boyle afirma o seguinte: A pressão exercida por uma força é fisicamente inversamente proporcional ao volume de matéria gasosa, desde que sua temperatura permaneça constante. Ou mais simplesmente, podemos interpretá-lo como: a uma temperatura constante mais alta, o volume de uma massa fixa de gás é inversamente proporcional à pressão constante que exerce.
Experimentos e aplicações da lei de Boyle

Para provar a teoria da Lei de Boyle, Mariot se encarregou de introduzir gás em um cilindro com pistão e pôde verificar as diferentes pressões que foram criadas à medida que o pistão descia. É inferido deste experimento que à medida que o volume aumenta, a pressão diminui.
A lei de Boyle tem muitas aplicações na vida moderna, entre as quais podemos citar por exemplo o mergulho, isso porque o mergulhador tem que expelir o ar de seus pulmões ao subir porque se expande quando a pressão diminui, se não o fizer pode causar danos nos tecidos.
É encontrado em todos os equipamentos que utilizam ou são acionados por energia pneumática, como braços robóticos que utilizam componentes como pistões pneumáticos, atuadores, reguladores de pressão e válvulas de alívio de pressão.
Motores a gasolina, gás ou diesel também usam a lei de Boyle durante a combustão interna, pois na primeira vez que o ar entra no cilindro com volume e pressão, na segunda vez reduz o volume aumentando a pressão.
Os carros possuem sistemas de airbag que funcionam expelindo uma certa quantidade de ar ou gás de uma câmara que atinge o airbag externo, onde a pressão diminui e o volume aumenta mantendo a temperatura constante.
A Lei de Boyle é muito importante hoje porque é a lei que nos fala e explica o comportamento dos gases. Isso definitivamente explica que a pressão e o volume de um gás são inversamente proporcionais entre si. Portanto, quando a pressão é aplicada a um gás, seu volume diminui e sua pressão aumenta.
modelo de gás ideal

A lei de Boyle-Mariotte se aplica aos chamados gases ideais, um modelo teórico que simplifica bastante o comportamento de qualquer gás, assumindo:
- moléculas de gás eles são tão pequenos que não é necessário pensar em seu tamanho, especialmente considerando que esta é muito menor do que a distância que eles percorrem.
- Além disso, as moléculas mal interagem, exceto quando colidem muito brevemente e, quando o fazem, a colisão é elástica, de modo que tanto o momento quanto a energia cinética são conservados.
- Finalmente, suponha que essa energia cinética seja proporcional à temperatura da amostra gasosa, ou seja, quanto mais agitadas as partículas, maior a temperatura.
Os gases leves, independentemente de sua identidade, seguem estas diretrizes de forma muito rigorosa sob condições padrão de temperatura e pressão (ou seja: 0ºC e pressão atmosférica (1 atmosfera).Para esses gases, a lei de Boyle-Mariotte descreve seu comportamento com muita precisão. .
Como P∙V é constante a uma dada temperatura, se a pressão do gás muda, o volume muda para que o produto permaneça o mesmo, então em dois estados diferentes 1 e 2, a igualdade pode ser expressa da seguinte forma:
P1∙V1 = P2∙V2
Então, conhecendo um estado, mais uma variável do outro estado, você pode conhecer a variável ausente removendo-a da lei de Boyle-Mariot.
História da Lei de Boyle
químico britânico. Pioneiro de experimentos no campo da química, especialmente nas propriedades dos gases,
A tese de Robert Boyle sobre o comportamento da matéria no nível das partículas foi precursora da moderna teoria dos elementos químicos. Ele também foi membro fundador da Royal Society de Londres.
Robert Boyle nasceu em uma família nobre na Irlanda e frequentou as melhores escolas inglesas e europeias. De 1656 a 1668 ele serviu como assistente de Robert Hooke na Universidade de Oxford, colaborando com ele em uma série de experimentos que determinaram as propriedades físicas do ar e como ele queima, respira e transmite som.
Os resultados dessas contribuições foram coletados em seu «Novas experiências físico-mecânicas sobre a elasticidade do ar e seus efeitos» (1660). Na segunda edição desta obra (1662), ele revelou a famosa propriedade dos gases, a lei de Boyle-Mariotte, que afirmava que o volume ocupado por um gás a temperatura constante é inversamente proporcional à sua pressão. Hoje sabe-se que esta lei só se cumpre quando se aceita o comportamento teórico ideal dos gases.
Espero que com essas informações você possa aprender mais sobre a lei de Boyle, suas características e aplicações no mundo da ciência.