
Czy kiedykolwiek widziałeś Model atomowy Bohra. To dość ważne odkrycie, które naukowiec dokonał dla nauki, zwłaszcza elektromagnetyzmu i elektrochemii. Wcześniej istniał model Rutherforda, który był dość rewolucyjny i bardzo udany, ale były pewne konflikty z innymi prawami atomowymi, takimi jak prawa Maxwella i Newtona.
W tym artykule powiemy Ci wszystko, co musisz wiedzieć o modelu atomowym Bohra, a także jego szczegóły, aby wyjaśnić wszelkie wątpliwości na ten temat.
Problemy, które pomogło rozwiązać
Jak wspomnieliśmy na początku artykułu, ten model atomowy pomógł rozwiązać pewne konflikty, które istniały z innymi prawami atomowymi. W poprzednim modelu Rutherforda musieliśmy elektrony poruszające się z ujemnym ładunkiem elektrycznym musiały emitować rodzaj promieniowania elektromagnetycznego. Powinno to zostać spełnione zgodnie z obowiązującymi tam prawami elektromagnetyzmu. Ta utrata energii powoduje, że elektrony są redukowane na ich orbitę poprzez spiralę w kierunku środka. Kiedy dotarli do środka, upadli, zderzając się z rdzeniem.
To stworzyło problem teoretyczny, ponieważ nie mogło zapaść się z jądrem atomów, ale trajektoria elektronów musiała być inna. Zostało to rozwiązane za pomocą modelu atomowego Bohra. To wyjaśnia elektrony krążą wokół jądra po pewnych dozwolonych orbitach, które mają określoną energię. Energia jest proporcjonalna do stałej Plancka.
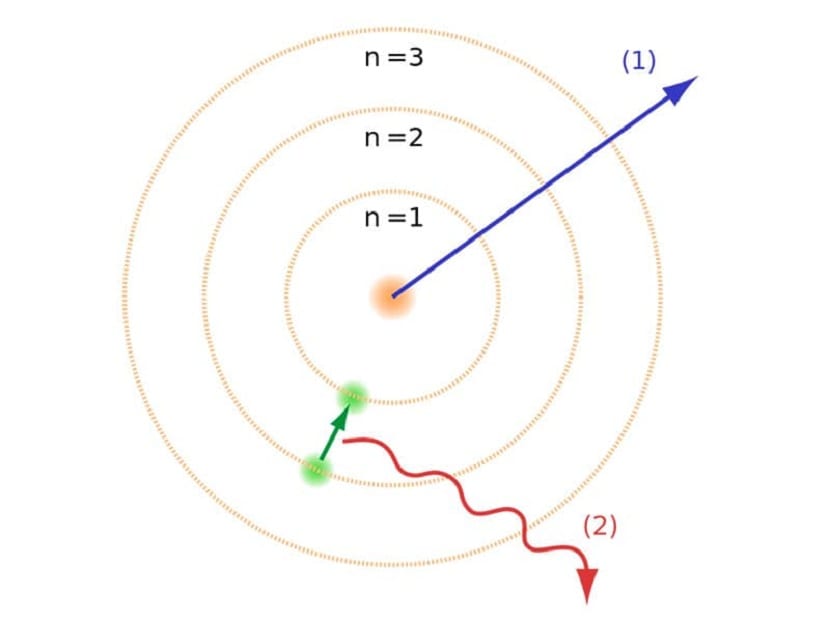
Te orbity, o których wspomnieliśmy, na których poruszają się elektrony, nazywano warstwami energii lub poziomami energii. Oznacza to, że energia elektronów nie jest zawsze taka sama, ale jest kwantowana. Poziomy kwantowe to różne orbity, na których znajdują się atomy. W zależności od tego, na jakiej orbicie się znajduje w danym momencie, będzie miał mniej lub więcej energii. Orbity bliżej jądra atomu mają większą ilość energii. Z drugiej strony im bardziej oddalają się od jądra, tym mniej energii.
Model poziomu energii
Ten model atomowy Bohra, który sugerował, że elektrony mogą zyskiwać lub tracić energię tylko przez przeskakiwanie z jednej orbity na drugą, pomógł w rozwiązaniu zapaści zaproponowanej przez model Rutherforda. Przechodząc z jednego poziomu energii na inny, pochłania lub emituje promieniowanie elektromagnetyczne. Oznacza to, że kiedy przeskakujesz z bardziej naładowanego poziomu energii na mniej naładowany, uwalniasz nadmiar energii. I odwrotnie, kiedy przechodzi z niskiego poziomu energii na wyższy, pochłania promieniowanie elektromagnetyczne.
Ponieważ ten model atomowy jest modyfikacją modelu Rutherforda, właściwości małego jądra centralnego i większości masy atomu są zachowane. Chociaż orbity elektronów nie są płaskie, jak orbity planet, można powiedzieć, że elektrony te obracają się wokół swojego jądra w podobny sposób jak planety wokół Słońca.
Zasady modelu atomowego Bohra

Teraz przeanalizujemy zasady tego modelu atomowego. Chodzi o szczegółowe wyjaśnienie wspomnianego modelu i jego działania.
- Cząsteczki o ładunku dodatnim Są w niskim stężeniu w porównaniu z całkowitą objętością atomu.
- Elektrony o ujemnym ładunku elektrycznym to takie, które krążą wokół jądra po kołowych orbitach energii.
- Istnieją poziomy energetyczne orbit, przez które krążą elektrony. Mają też ustalony rozmiar, więc między orbitami nie ma stanu pośredniego. Po prostu przechodzą z jednego poziomu na drugi.
- Energia, jaką posiada każda orbita, jest związana z jej rozmiarem. Im dalej orbita znajduje się od jądra atomu, tym więcej ma energii.
- Poziomy energii mają różną liczbę elektronów. Im niższy poziom energii, tym mniej elektronów zawiera. Na przykład, jeśli jesteśmy na poziomie pierwszym, będzie do dwóch elektronów. Na poziomie 2 może być do 8 elektronów i tak dalej.
- Kiedy elektrony przemieszczają się z jednej orbity na drugą, pochłaniają lub uwalniają energię elektromagnetyczną. Jeśli przejdziesz z jednego poziomu energii więcej na inny mniejszy, uwolnisz pozostałą energię i odwrotnie.
Ten model był rewolucyjny i starał się nadać materiałowi stabilność, której nie miały poprzednie modele. Za pomocą tego modelu atomowego wyjaśniono również dyskretne widma emisji i absorpcji gazów. Był to pierwszy model, który wprowadził koncepcję kwantyzacji lub kwantyzacji. To sprawia, że model atomowy Bohra jest modelem znajdującym się w połowie drogi między mechaniką klasyczną a mechaniką kwantową. Chociaż ma również wady, był to model prekursorski dla późniejszej mechaniki kwantowej Schrödingera i innych naukowców.
Ograniczenia i błędy modelu atomowego Bohra
Jak wspomnieliśmy, model ten ma też pewne wady i błędy. Przede wszystkim nie wyjaśnia ani nie podaje powodów, dla których elektrony powinny być ograniczane tylko do określonych orbit. Zakłada bezpośrednio, że elektrony mają znany promień i orbitę. Jednak tak nie jest. Dziesięć lat później Zasada nieoznaczoności Heisenberga obaliła to.
Chociaż ten model atomowy był w stanie zamodelować zachowanie elektronów w atomach wodoru, nie był on tak dokładny, jeśli chodzi o pierwiastki o większej liczbie elektronów. To jest wzór ma problem z wyjaśnieniem efektu Zeemana. Ten efekt można zobaczyć, gdy linie widmowe są podzielone na dwie lub więcej w obecności zewnętrznego i statycznego pola magnetycznego.
Kolejnym błędem i ograniczeniami tego modelu jest to, że podaje on nieprawidłową wartość momentu pędu orbity stanu podstawowego. Wszystkie wymienione błędy i ograniczenia powodują, że atomowy model Bohra został po latach zastąpiony przez teorię kwantową.
Mam nadzieję, że z tego artykułu dowiesz się więcej o modelu atomowym Bohra i jego zastosowaniach w nauce.