
W nauce było wielu naukowców, którzy dokonali zmian, jeśli chodzi o wiedzę, jak działają rzeczy. Wiedza na temat cząstek, atomów i elektronów zapewniła wiele postępów w nauce. Dlatego zamierzamy poświęcić ten artykuł Model atomowy Thomsona. Był również znany jako model budyniu z rodzynkami.
W tym artykule możesz dowiedzieć się wszystkiego, co dotyczy modelu atomowego Thomsona, jakie są jego cechy i jak ważny był dla nauki.
Co to jest model atomowy Thomsona

Jest to model, który został opracowany w 1904 roku i być może odkryto pierwszą cząstkę subatomową. Odkrywcą był brytyjski naukowiec Joseph John Thomson. Ten człowiek był w stanie odkryć ujemnie naładowane cząstki w wyniku eksperymentu, w którym użył lamp katodowych w 1897 roku.
Konsekwencje tego odkrycia były olbrzymie, ponieważ nie było dowodów na to, że atom może mieć jądro. Ten naukowiec prowadzi nas do wniosku, że elektrony były zanurzone w rodzaju dodatnio naładowanej substancji, która przeciwdziała ujemnemu ładunkowi elektronów. To właśnie sprawiło, że atomy mają ładunek neutralny.
Wyjaśnienie ich w zrozumiały sposób jest jak umieszczenie galaretki z unoszącymi się w środku rodzynkami. Stąd nazwa modelu budyń z rodzynkami. W tym modelu Thomson był odpowiedzialny za wywoływanie cząsteczek elektronów i uważał, że są one ułożone w sposób nieprzypadkowy. Dziś wiadomo, że są to coś w rodzaju obracających się pierścieni i że każdy z nich ma inny poziom energii. Kiedy elektron traci energię, przechodzi na wyższy poziom, to znaczy oddala się od jądra atomu.
Eksperyment ze złotą folią

Thompson pomyślał, że dodatnia część atomu zawsze pozostaje na czas nieokreślony. Ten model, który stworzył w 1904 r., Nie zyskał powszechnej akademickiej akceptacji. Pięć lat później Geiger i Marsden byli w stanie przeprowadzić eksperyment ze złotą folią, który sprawił, że odkrycia Thomsona były mniej skuteczne. W tym eksperymencie zdali wiązka cząstek helu alfa przez złotą folię. Cząsteczki alfa to nic innego jak lwy pierwiastka, czyli jądra, które nie mają elektronów i dlatego mają ładunek dodatni.
Rezultatem eksperymentu było to, że wiązka ta została rozproszona, kiedy przeszła przez złotą folię. Na tej podstawie można by wywnioskować, że musi istnieć jądro ze źródłem dodatniego ładunku, które jest odpowiedzialne za odchylanie wiązki światła. Z drugiej strony, w modelu atomowym Thomsona mieliśmy, że ładunek dodatni był rozłożony na to, co nazywano żelatyną, a które zawierało elektrony. Oznacza to, że wiązka jonów mogłaby przejść przez atom tego modelu.
Gdy w kolejnym eksperymencie było odwrotnie, ten model może zostać odrzucony atomowy.
Odkrycie elektronu również pochodziło z części innego modelu atomu, ale od Daltona. W tym modelu atom uznano za całkowicie niepodzielny. To właśnie skłoniło Thomsona do zastanowienia się nad modelem puddingu z rodzynkami.
Charakterystyka modelu atomowego Thomsona
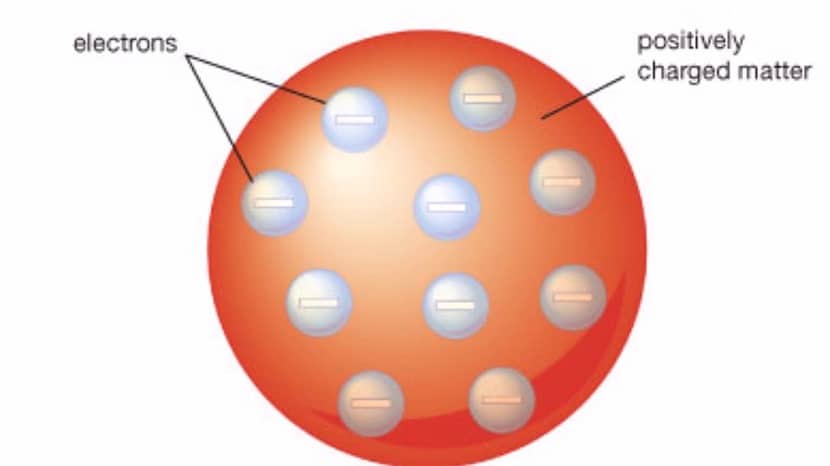
Wśród głównych cech tego modelu podsumowujemy:
- Atom, który reprezentuje ten model przypomina kulę zawierającą dodatnio naładowany materiał z elektronami które są naładowane ujemnie. Wewnątrz kuli znajdują się zarówno elektrony, jak i dodatnio naładowana materia.
- Ładunki dodatnie i ujemne mają tę samą wielkość. Oznacza to, że cały atom nie ma ładunku, ale jest elektrycznie obojętny.
- Aby atom w ogóle mógł mieć ładunek neutralny elektrony muszą być zanurzone w substancji, która ma ładunek dodatni. To właśnie wspomina się z rodzynkami jako częścią elektronów, a reszta żelatyny to część z ładunkiem dodatnim.
- Chociaż nie jest to wyjaśnione w jednoznaczny sposób, można wywnioskować, że w tym modelu jądro atomowe nie istniało.
Tworząc ten model, Thomson porzucił poprzednią hipotezę dotyczącą atomu mgławicy. Ta hipoteza została oparta na fakcie, że atomy składają się z niematerialnych wirów. Będąc utalentowanym naukowcem, chciał stworzyć swój własny model atomowy w oparciu o eksperymentalne dowody, które były znane w jego czasach.
Pomimo tego, że model ten nie był do końca dokładny, był w stanie pomóc w ułożeniu stałego fundamentu, aby późniejsze modele mogły odnieść większy sukces. Dzięki takiemu modelowi można było przeprowadzić różne eksperymenty, które doprowadziły do nowych wniosków i tak rozwijała się nauka, którą znamy dzisiaj.
Ograniczenia i błędy modelu atomowego Thomsona
Przeanalizujemy, w jakich kwestiach ten model nie trafił w sedno i przez to nie mógł ruszyć do przodu. Po pierwsze, nie potrafił wyjaśnić, w jaki sposób ładunki są utrzymywane na elektronach wewnątrz atomu. Nie będąc w stanie tego wyjaśnić, nie potrafił również rozwiązać niczego na temat stabilności atomu.
W swojej teorii nie wspomniał nic o atomie posiadającym jądro. Gdybyśmy dzisiaj wiedzieli, że atom składa się z jądro złożone z protonów i neutronów oraz elektronów obraca się wokół na różnych poziomach energii.
Protony i neutrony nie zostały jeszcze odkryte. Thompson próbował oprzeć swój model na wyjaśnieniu z elementami, które zostały wówczas naukowo udowodnione. Kiedy zweryfikowano eksperyment ze złotą folią, szybko go wyrzucono. W tym eksperymencie wykazano, że w atomie musi znajdować się coś, co nadałoby mu ładunek dodatni i większą masę. Wiadomo już, że jest to jądro atomu.
Mam nadzieję, że dzięki tym informacjom możesz dowiedzieć się więcej o modelu atomowym Thomsona.