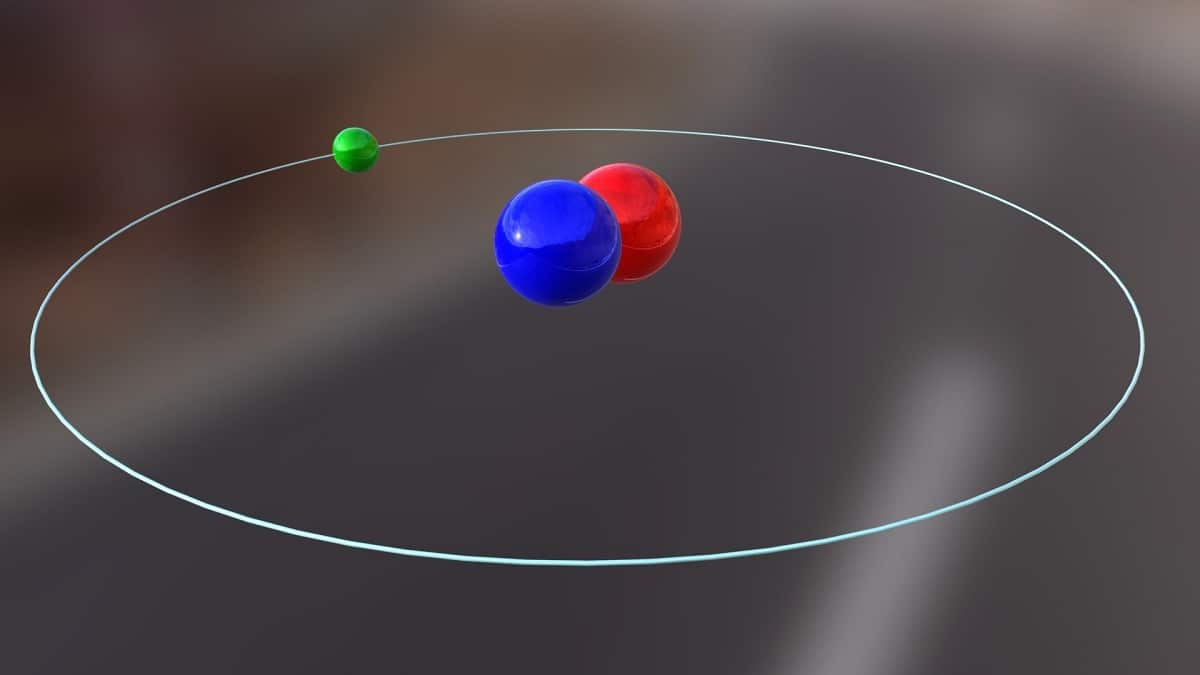
I dag skal vi snakke om en isotop som brukes til å produsere kjernekraft. Det handler om deuterium. Det er en av isotopartene av hydrogen og er representert med symbolet D eller 2H. Det har fått det vanlige navnet tungt hydrogen fordi massen er dobbelt så stor som protonen. En isotop er ikke noe mer enn en art som kommer fra det samme kjemiske elementet, men som har et annet massetall. Deuterium brukes til forskjellige formål.
Derfor skal vi dedikere denne artikkelen for å fortelle deg om alle egenskaper, struktur, egenskaper og bruk av deuterium.
Hovedkarakteristikker
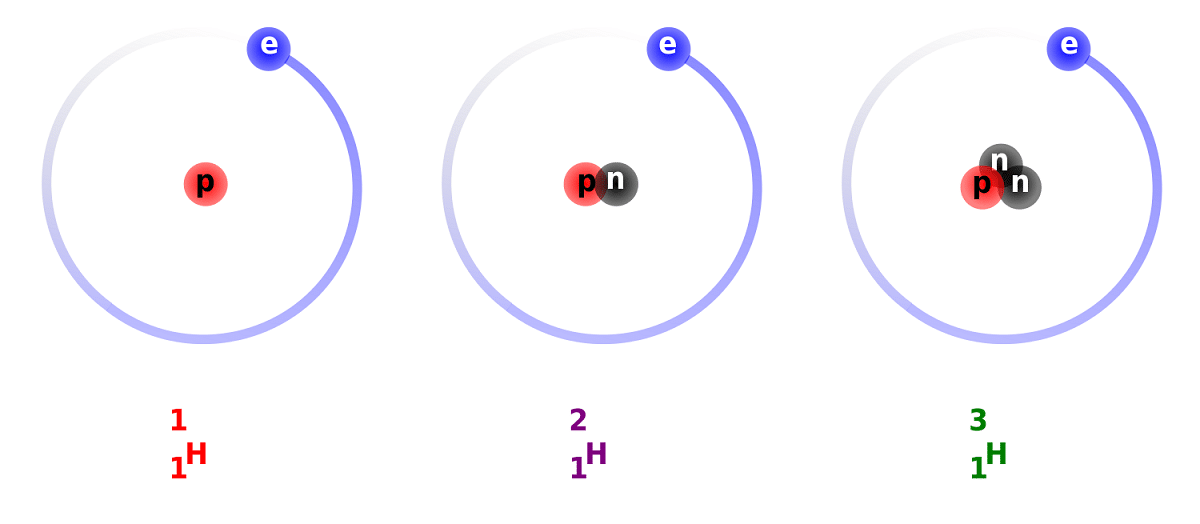
Skillet mellom deuterium og hydrogen skyldes forskjellen i antall nøytroner det har. Av denne grunn betraktes deuterium som en stabil isotop og kan finnes i forbindelser dannet av hydrogen av helt naturlig opprinnelse. Det må tas i betraktning at selv om de er av naturlig opprinnelse, forekommer de i liten andel. Gitt egenskapene har den så mye som vanlig hydrogen, kan erstatte den i sin helhet i reaksjonene den deltar i. På denne måten kan den omdannes til ekvivalente stoffer.
Av denne og andre grunner har deuterium et stort antall applikasjoner innen forskjellige vitenskapsområder. Det har i løpet av årene blitt et av de viktigste elementene for forskning og fremskritt innen teknologi og informasjon.
Hovedstrukturen til denne isotopen består av en kjerne som har en proton og et nøytron. Den har en atomvekt på omtrent 2,014 gram. Denne isotopen ble oppdaget takket være Harold C. Urey, en kjemiker fra USA, og hans samarbeidspartnere Ferdinand Brickwedde og George Murphy, i 1931. Forberedelsene til å møte deuterium i sin rene tilstand ble utført vellykket for første gang i 1933. Det er allerede på 50-tallet da en solid fase som viste stor stabilitet, kjent som litiumdeuterid, begynte å bli brukt. Dette stoffet kan erstatte deuterium og tritium i et stort antall kjemiske reaksjoner.
Fremskritt innen vitenskap oppstår når et stoff blir funnet som kan lette kjemiske reaksjoner for generering av produkter. I denne forstand, hvis du studerte overflod av denne isotopen for å være i stand til å observere visse ting. Det har vært kjent at andelen deuterium i vannet varierer litt avhengig av området der prøven tas. Det er noen spektroskopi-studier som har bestemt eksistensen av denne isotopen på andre planeter i galaksen vår. Dette kan være av stor betydning for å studere sammensetningen av andre himmellegemer.
Struktur og opprinnelse til deuterium

Vi kommer til å vite noen fakta om deuterium. Som vi har nevnt tidligere, ligger hovedforskjellen mellom hydrogenisotoper i deres struktur. Og er det at hydrogen, deuterium og tritium har forskjellige mengder protoner og nøytroner, så de har forskjellige kjemiske egenskaper. Jeg må også huske på at deuterium som finnes i andre stjernekropper elimineres med større hastighet enn det er opprinnelsen. Dette er en av grunnene til at det er så vanskelig å studere tilstedeværelsen av deuterium i stjernekropper.
Andre naturfenomener anses å danne en liten mengde deuterium, så produksjonen fortsetter å generere betydelig interesse i dag. Fra den prosentandelen vi har nevnt tidligere om tilstedeværelsen av deuterium i naturen, det utgjør ikke 0.02%. En rekke vitenskapelige undersøkelser har avdekket at det store flertallet av atomene som har blitt dannet av deuterium, naturlig stammer fra eksplosjonen som ga opphav til universets opprinnelse kjent som Big Bang. Dette er en av hovedårsakene til at deuterium antas å være til stede i store planeter som Jupiter.
Den vanligste måten å få denne isotopen naturlig er når de kombineres med hydrogen. Når dette skjer, vil det kombineres i protiumform. Forskere er interessert i å vite forholdet som er etablert mellom andelen deuterium og hydrogen innen forskjellige vitenskapsfelt. Det er mye studert i grener av vitenskap som astronomi eller klimatologi. I disse grenene har det noen praktiske verktøy for å kjenne og forstå universet og atmosfæren vår.
Egenskaper av deuterium

Vi kommer til å vite hva som er de viktigste egenskapene som denne isotopen tilhører hydrogen. Det første du må gjøre er å vite hva en isotop uten radioaktive egenskaper er. Dette betyr at den er ganske stabil i naturen. Det kan brukes til å erstatte hydrogen i forskjellige kjemiske reaksjoner. Ved å ha stor stabilitet naturlig, viser en annen oppførsel enn vanlig hydrogen. Dette skjer i alle reaksjoner som har en biokjemisk natur. Det er nødvendig å vite før man bytter ut, at selv om det kan nås ved å bytte hydrogen mot deuterium i kjemiske reaksjoner, må det være kjent at de vil ha en annen oppførsel.
Når de to hydrogenatomene i vann erstattes, kan en forbindelse kjent som tungt vann oppnås. Hydrogenet som er tilstede i havet, og som er i form av deuterium den presenterer bare en andel på 0,016% i forhold til protium. I universet har denne isotopen en tendens til å smelte raskere for å gi opphav til helium. Hvis vi kombinerer deuterium med atomoksygen, ser vi at det blir en giftig art. Til tross for dette, og de kjemiske egenskapene eller som ligner de på hydrogen.
En annen av egenskapene til denne isotopen er at når deuteriumatomer utsettes for kjernefusjonsprosessen ved høye temperaturer, kan store mengder energi frigjøres. Det er utvandringen, du har studert for å kunne implantere kjernefusjonen på planeten vår. Noen fysiske egenskaper som kokepunkt, fordampningsvarme, trippelpunkt og tetthet de har større størrelser enn hydrogen.
Jeg håper at med denne informasjonen kan du lære mer om deuterium og dets egenskaper.