
Sikkert har du noen gang sett Bohr atommodell. Dette er en ganske viktig oppdagelse som denne forskeren gjorde for vitenskap, spesielt elektromagnetisme og elektrokjemi. Tidligere var det Rutherford-modellen, som var ganske revolusjonerende og veldig vellykket, men det var noen konflikter med andre atomlover som Maxwells og Newtons.
I denne artikkelen skal vi fortelle deg alt du trenger å vite om Bohrs atommodell, samt detaljene for å avklare enhver tvil om emnet.
Problemer det hjalp til med å løse
Som vi nevnte i begynnelsen av artikkelen, bidro denne atommodellen til å løse visse konflikter som eksisterte med andre atomlover. I den forrige Rutherford-modellen måtte vi elektroner som beveget seg med en negativ elektrisk ladning måtte avgi en type elektromagnetisk stråling. Dette bør oppfylles på grunn av lovene om elektromagnetisme der ute. Dette tapet av energi fører til at elektronene reduseres til sin bane ved å snu seg mot sentrum. Da de nådde sentrum kollapset de, kolliderte med kjernen.
Dette genererte i teorien et problem siden det ikke kunne kollapse med atomkjernen, men elektronenes bane måtte være annerledes. Dette ble løst med Bohr-atommodellen. Det forklarer det elektronene kretser rundt kjernen i visse baner som er tillatt og som har en spesifikk energi. Energi er proporsjonal med Plancks konstant.
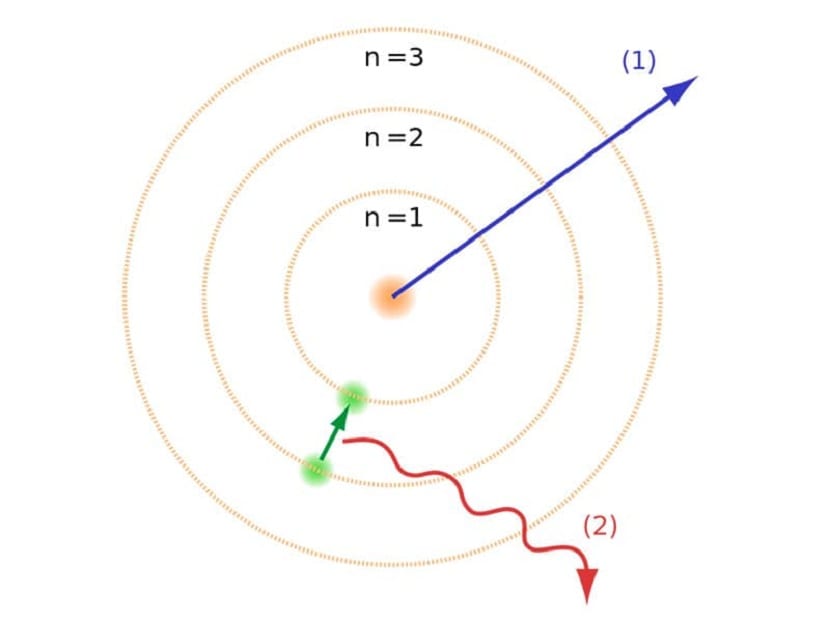
Disse banene som vi har nevnt hvor elektronene beveger seg, ble kalt energilag eller energinivåer. Det vil si at energien som elektroner har er ikke alltid den samme, men blir kvantifisert. Kvantinnivåer er de forskjellige banene der atomer er funnet. Avhengig av hvilken bane det er i et gitt øyeblikk, vil den ha mer eller mindre energi. Banene nærmere atomkjernen har større energi. På den annen side, jo lenger bort fra kjernen desto mindre energi.
Energinivåmodell
Denne Bohr-atommodellen, som antydet at elektroner bare kunne få eller miste energi ved å hoppe fra en bane til en annen, bidro til å løse sammenbruddet som ble foreslått av Rutherfords modell. Når du beveger deg fra ett energinivå til et annet, absorberer eller avgir den elektromagnetisk stråling. Det vil si at når du hopper fra et mer ladet energinivå til et mindre ladet, frigjør du overflødig energi. Omvendt, når det går fra et lavt energinivå til et høyere, absorberer det elektromagnetisk stråling.
Siden denne atommodellen er en modifikasjon av Rutherford-modellen, opprettholdes egenskapene til den lille sentrale kjernen og med det meste av massen til atomet. Selv om banene til elektronene ikke er flate som planetenes, kan det sies at disse elektronene roterer rundt kjernen på samme måte som planetene gjør rundt solen.
Bohrs atommodellprinsipper

Vi skal nå analysere prinsippene i denne atommodellen. Det handler om en detaljert forklaring av nevnte modell og dens drift.
- Partikler som har en positiv ladning De er i lav konsentrasjon sammenlignet med atomets totale volum.
- Elektroner med negativ elektrisk ladning er de som finnes roterende rundt kjernen i sirkulære baner av energi.
- Det er energinivåer i banene som elektronene sirkulerer gjennom. De har også en bestemt størrelse, så det er ingen mellomtilstand mellom banene. De går bare fra ett nivå til et annet.
- Energien som hver bane har, er relatert til størrelsen. Jo lenger bane er fra atomkjernen, jo mer energi har den.
- Energinivåer har forskjellige antall elektroner. Jo lavere energinivå, jo færre elektroner inneholder det. Hvis vi for eksempel er på nivå ett, vil det være opptil to elektroner. På nivå 2 kan det være opptil 8 elektroner, så videre.
- Når elektroner beveger seg fra en bane til en annen, absorberer eller frigjør de elektromagnetisk energi. Hvis du går fra ett mer energisk nivå til et annet mindre, frigjør du overflødig energi og omvendt.
Denne modellen var revolusjonerende og prøvde å gi en stabilitet i materialet som de tidligere modellene ikke hadde. Gassens diskrete utslipp og absorpsjon ble også forklart med denne atommodellen. Det var den første modellen som introduserte begrepet kvantisering eller kvantisering. Dette gjør Bohrs atommodell til en modell som er halvveis mellom klassisk mekanikk og kvantemekanikk. Selv om den også har mangler, var den en forløpermodell for den senere kvantemekanikken til Schrödinger og andre forskere.
Begrensninger og feil i Bohr-atommodellen
Som vi har nevnt, har denne modellen også visse mangler og feil. Først og fremst forklarer eller gir det ikke grunner til at elektroner bare må begrenses til spesifikke baner. Det forutsetter direkte at elektroner har en kjent radius og bane. Dette er imidlertid ikke slik. Et tiår senere Heisenbergs usikkerhetsprinsipp motbeviste dette.
Selv om denne atommodellen var i stand til å modellere oppførselen til elektroner i hydrogenatomer, var den ikke så nøyaktig når det gjelder elementer med et høyere antall elektroner. Det er en modell som har problemer med å forklare Zeeman-effekten. Denne effekten er det som kan sees når spektrallinjene er delt i to eller flere i nærvær av et eksternt og statisk magnetfelt.
En annen av feilene og begrensningene som denne modellen har, er at den gir en feilverdi for vinkelmomentet til bakken. Alle nevnte feil og begrensninger gjør at Bohrs atommodell ble erstattet av kvanteteori år senere.
Jeg håper at du med denne artikkelen kan lære mer om Bohrs atommodell og dens anvendelser innen vitenskap.