Op het gebied van de natuurkunde is er een afdeling die verantwoordelijk is voor het bestuderen van de transformaties die worden veroorzaakt door warmte en werk in het systeem. Het gaat over thermodynamica. Het is een tak van de natuurkunde die verantwoordelijk is voor de studie van alle overgangen, die alleen het resultaat zijn van een proces dat veranderingen in de toestandsvariabelen van temperatuur en energie op macroniveau met zich meebrengt. Er zijn meerdere principes van thermodynamica die fundamenteel zijn voor veel aspecten van de natuurkunde.
Daarom gaan we je in dit artikel vertellen wat de principes van thermodynamica zijn en wat het belang ervan is.
Kenmerken van thermodynamica
Als we de klassieke thermodynamica analyseren, zullen we ontdekken dat deze gebaseerd is op het concept van macroscopische systemen. Dit systeem is slechts een deel van de fysieke of conceptuele kwaliteit van scheiding van de externe omgeving. Om het thermodynamische systeem beter te kunnen bestuderen, wordt altijd aangenomen dat het een fysieke massa is die het wordt niet verstoord door de uitwisseling van energie met het externe ecosysteem.
De toestand van een macroscopisch systeem in evenwicht wordt gespecificeerd door grootheden die thermodynamische variabelen worden genoemd. We kennen al deze variabelen: temperatuur, druk, volume en chemische samenstelling. Al deze variabelen bepalen het systeem en zijn evenwicht. Dankzij de internationale alliantie van toepassingen zijn de belangrijkste symbolen van de chemische thermodynamica vastgesteld. Het gebruik van deze eenheden kan beter werken en de principes van thermodynamica uitleggen.
Echter er is een tak van de thermodynamica die het evenwicht niet bestudeert, In plaats daarvan zijn ze verantwoordelijk voor het analyseren van thermodynamische processen die voornamelijk worden gekenmerkt door niet in staat te zijn om op een stabiele manier evenwichtscondities te bereiken.
Principes van thermodynamica
Er zijn 4 principes van de thermodynamica, opgesomd van nul tot drie punten, deze wetten helpen om alle wetten van de fysica in ons universum te begrijpen en het is onmogelijk om bepaalde verschijnselen in onze wereld te zien. Ze zijn ook bekend onder de naam van de wetten van de thermodynamica. Deze wetten hebben een verschillende oorsprong. Sommige zijn geformuleerd op basis van eerdere formules. De laatst bekende wet van de thermodynamica is de nulwet. Deze wetten zijn permanent in alle onderzoeken en onderzoeken die in het laboratorium worden uitgevoerd. Ze zijn essentieel om te begrijpen hoe ons universum werkt. We zullen de principes van de thermodynamica één voor één beschrijven.
Eerste principe:
Deze wet zegt dat energie niet kan worden gecreëerd of vernietigd, het kan alleen worden getransformeerd. Dit wordt ook wel de wet van behoud van energie genoemd. Werkelijk, dit betekent dat in elk fysiek systeem dat geïsoleerd is van zijn omgeving, al zijn energie altijd hetzelfde zal zijn. Hoewel energie in een of andere vorm kan worden omgezet in andere soorten energie, is de som van al deze energieën altijd hetzelfde.
We zullen een voorbeeld geven om het beter te begrijpen. Volgens dit principe kunnen we, als we een bepaalde hoeveelheid energie bijdragen aan een fysiek systeem in de vorm van warmte, de totale energie berekenen door het verschil te vinden tussen de toename van interne energie en het werk dat door het systeem en zijn omgeving wordt gedaan. Dat wil zeggen, het verschil tussen de energie die het systeem op dat moment heeft en het werk dat het heeft gedaan, is de thermische energie die vrijkomt.
tweede principe:
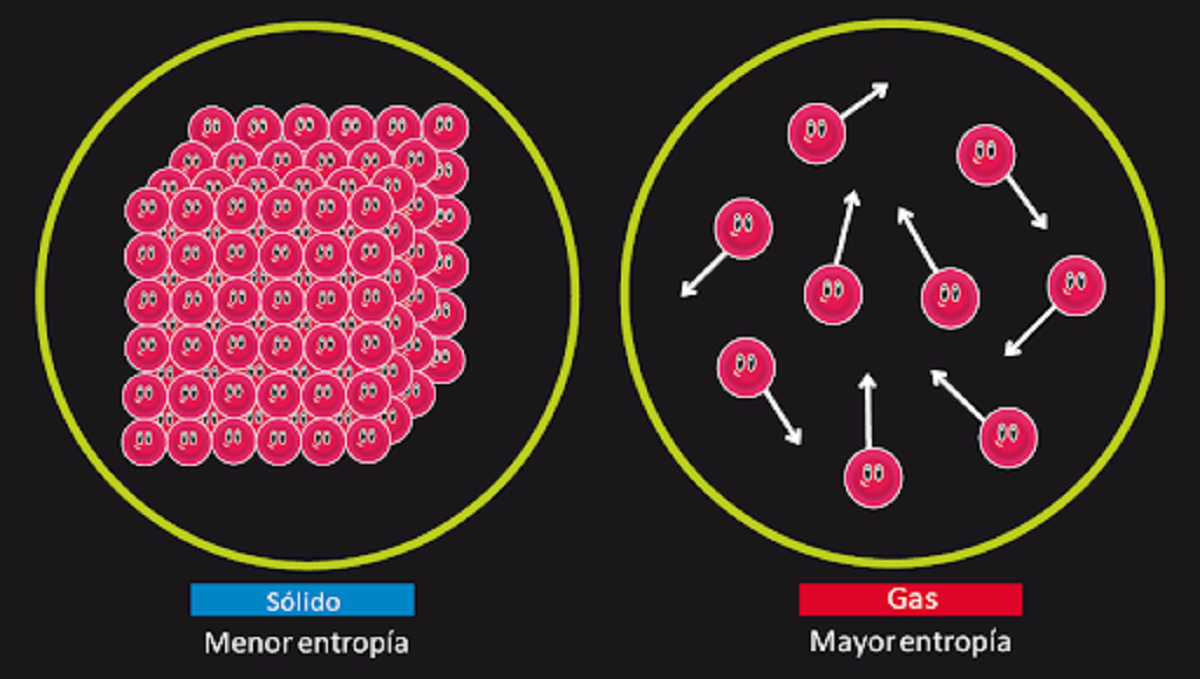
Als er genoeg tijd is, zullen alle systemen uiteindelijk hun evenwicht verliezen. Dit principe wordt ook wel de wet van entropie genoemd. Het kan als volgt worden samengevat. De hoeveelheid entropie in het heelal zal in de loop van de tijd toenemen. De entropie van het systeem is een index om de mate van wanorde te meten. Met andere woorden, Het tweede principe van de thermodynamica vertelt ons dat zodra het systeem een evenwichtspunt bereikt, het zal de mate van wanorde in het systeem vergroten. Dit kan betekenen dat als we een systeem voldoende tijd geven, het op den duur uit balans raakt.
Dit is de wet die verantwoordelijk is voor het verklaren van de onomkeerbaarheid van sommige fysieke verschijnselen. Het helpt ons bijvoorbeeld uit te leggen waarom een paper een papier is verbrand kan niet terugkeren naar zijn oorspronkelijke vorm. In dit systeem dat bekend staat als papier en vuur, is de wanorde zodanig toegenomen dat het niet meer mogelijk is om terug te keren naar de oorsprong. Deze wet introduceert de entropie-toestandsfunctie, die in het geval van fysieke systemen verantwoordelijk is voor het weergeven van de mate van wanorde en het onvermijdelijke verlies van energie.
Om het tweede principe van de thermodynamica te begrijpen, gaan we een voorbeeld geven. Als we een bepaalde hoeveelheid materie verbranden en we leggen de bal samen met de resulterende as, dan kunnen we zien dat er minder materie is dan in de begintoestand. Dit komt omdat materie is veranderd in gassen die Ze kunnen niet worden teruggevonden en ze moeten zich verspreiden en rommelig maken. Dit is hoe we zien dat er in staat één op zijn minst entropie was dan in staat twee.
derde principe:
Wanneer het absolute nulpunt wordt bereikt, stopt het fysieke systeemproces. Het absolute nulpunt is de laagste temperatuur die we kunnen bereiken. In dit geval meten we de temperatuur in graden Kelvin. Op deze manier kan worden gezegd dat de temperatuur en de koeling ervoor zorgen dat de entropie van het systeem nul is. In deze gevallen is het meer een bepaalde constante. Wanneer het het absolute nulpunt bereikt, stopt het fysieke systeemproces. Daarom zal de entropie een minimale maar constante waarde hebben.
Het bereiken van het absolute nulpunt of niet is een gemakkelijke taak. De absolute nulwaarde van de Kelvin-graad is nul, maar als we het gebruiken in Celsius temperatuurschaal meting, is -273,15 graden.
Geen wet
Deze wet is de laatste nam aan en zegt dat als A = C en B = C, dan A = B. Dit stelt de basis- en basisregels van de andere drie wetten van de thermodynamica vast. Het is een naam die uitgaat van de wet van thermisch evenwicht. Met andere woorden, als het systeem en andere systemen onafhankelijk in thermisch evenwicht zijn, moeten ze in thermisch evenwicht zijn. Deze wet maakt het mogelijk temperatuurprincipes vast te stellen. Dit principe wordt gebruikt om de thermische energie van twee verschillende objecten in een toestand van thermisch evenwicht te vergelijken. Als deze twee objecten in thermisch evenwicht zijn, zullen ze onnodig op dezelfde temperatuur zijn. Aan de andere kant, als ze allebei de thermische balans van het derde systeem veranderen, zullen ze elkaar ook beïnvloeden.
Ik hoop dat je met deze informatie meer kunt leren over de principes van de thermodynamica van zijn kenmerken.