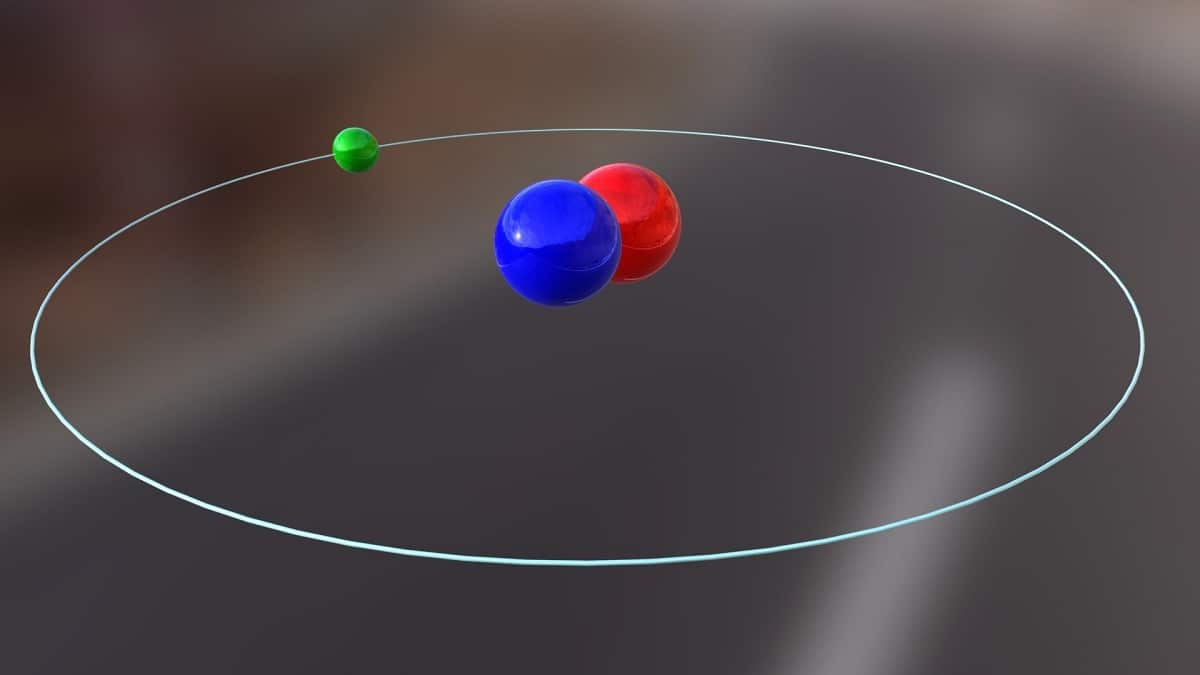
Vandaag gaan we het hebben over een isotoop die wordt gebruikt om kernenergie te produceren. Het gaat over deuterium Het is een van de isotoopsoorten van waterstof en wordt weergegeven door het symbool D of 2H. Het heeft de algemene naam zware waterstof gekregen omdat de massa tweemaal zo groot is als die van het proton. Een isotoop is niets meer dan een soort die uit hetzelfde chemische element komt maar een ander massagetal heeft. Deuterium wordt voor verschillende doeleinden gebruikt.
Daarom gaan we dit artikel wijden om u te vertellen over alle kenmerken, structuur, eigenschappen en toepassingen van deuterium.
hoofdkenmerken
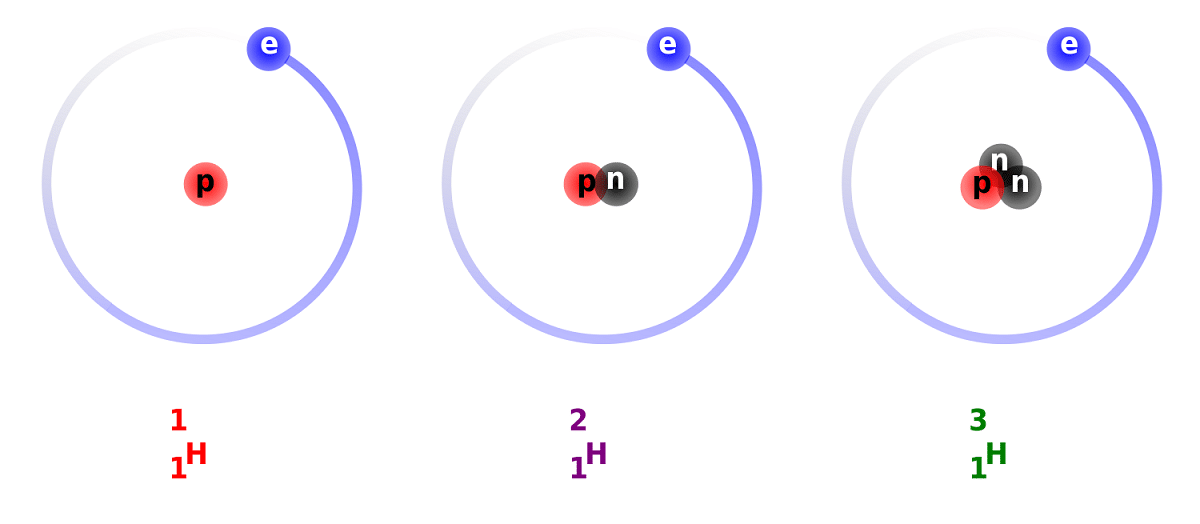
Het onderscheid tussen deuterium en waterstof is te wijten aan het verschil in het aantal neutronen dat het heeft. Om deze reden wordt deuterium als een stabiele isotoop beschouwd en kan het worden aangetroffen in verbindingen die worden gevormd door waterstof van volledig natuurlijke oorsprong. Houd er rekening mee dat ze, hoewel ze van natuurlijke oorsprong zijn, in een klein deel voorkomen. Gezien de eigenschappen heeft het zo veel overeenkomsten met gewone waterstof, kan het in zijn geheel vervangen in de reacties waaraan het deelneemt Op deze manier kan het worden omgezet in gelijkwaardige stoffen.
Om deze en andere redenen heeft deuterium een groot aantal toepassingen in verschillende wetenschapsgebieden. Het is in de loop der jaren een van de belangrijkste elementen geworden voor onderzoek en vooruitgang op het gebied van technologie en informatie.
De hoofdstructuur van deze isotoop bestaat uit een kern met een proton en een neutron. Het heeft een atoomgewicht van ongeveer 2,014 gram. Deze isotoop werd ontdekt dankzij Harold C. Urey, een chemicus uit de Verenigde Staten, en zijn medewerkers Ferdinand Brickwedde en George Murphy, in 1931. De voorbereiding om deuterium in zijn zuivere staat te ontmoeten, werd voor het eerst met succes uitgevoerd in 1933. Het is al in de jaren 50 toen een vaste fase werd gebruikt die een grote stabiliteit vertoonde, bekend als lithiumdeuteride. Deze stof zou deuterium en tritium kunnen vervangen bij een groot aantal chemische reacties.
Vooruitgang in de wetenschap vindt plaats wanneer een stof wordt gevonden die chemische reacties voor het genereren van producten kan vergemakkelijken. In die zin, als je de overvloed van deze isotoop hebt bestudeerd om bepaalde dingen te kunnen observeren. Het is bekend dat het aandeel deuterium in het water enigszins varieert, afhankelijk van het gebied waar het monster wordt genomen. Er zijn enkele spectroscopie-onderzoeken die hebben het bestaan van deze isotoop op andere planeten in onze melkweg vastgesteld. Dit kan van groot belang zijn om de samenstelling van andere hemellichamen te bestuderen.
Structuur en oorsprong van deuterium

We gaan enkele feiten over deuterium weten. Zoals we eerder hebben vermeld, ligt het belangrijkste verschil tussen waterstofisotopen in hun structuur. En is dat waterstof, deuterium en tritium verschillende hoeveelheden protonen en neutronen hebben, dus verschillende chemische eigenschappen. Ik moet ook in gedachten houden dat het deuterium dat in andere stellaire lichamen bestaat, met grotere snelheid wordt verwijderd dan het is ontstaan. Dit is een van de redenen waarom het zo moeilijk is om de aanwezigheid van deuterium in stellaire lichamen te bestuderen.
Van andere natuurverschijnselen wordt aangenomen dat ze een kleine hoeveelheid deuterium vormen, dus de productie ervan blijft vandaag de dag aanzienlijke belangstelling wekken. Van het percentage dat we eerder hebben genoemd over de aanwezigheid van deuterium in de natuur, het bedraagt geen 0.02%. Een reeks wetenschappelijke onderzoeken heeft onthuld dat de overgrote meerderheid van de atomen die zijn gevormd uit deuterium van nature afkomstig zijn uit de explosie die aanleiding gaf tot de oorsprong van het universum dat bekend staat als Big Bang Dit is een van de belangrijkste redenen waarom men denkt dat deuterium aanwezig is op grote planeten zoals Jupiter.
De meest gebruikelijke manier om deze isotoop op natuurlijke wijze te verkrijgen, is door ze te combineren met waterstof. Wanneer dit gebeurt, wordt het gecombineerd in de vorm van een protium. Wetenschappers zijn geïnteresseerd in het kennen van de relatie tussen het aandeel van deuterium en waterstof in verschillende wetenschapsgebieden. Het wordt veel bestudeerd in takken van wetenschap, zoals astronomie of klimatologie. In deze takken heeft het enkele praktische mogelijkheden om het universum en onze atmosfeer te kennen en te begrijpen.
Eigenschappen van deuterium

We gaan weten wat de belangrijkste eigenschappen zijn van deze isotoop van waterstof. Het eerste dat u moet doen, is weten wat een isotoop zonder radioactieve kenmerken is. Dit betekent dat het vrij stabiel van aard is. Het kan worden gebruikt om waterstof te vervangen bij verschillende chemische reacties. Door van nature een grote stabiliteit te hebben, vertoont een ander gedrag dan gewone waterstof Dit gebeurt bij alle reacties die biochemisch van aard zijn. Het is noodzakelijk om te weten alvorens te vervangen, dat hoewel het kan worden bereikt door waterstof in te ruilen voor deuterium in chemische reacties, het bekend moet zijn dat ze een ander gedrag zullen hebben.
Wanneer de twee waterstofatomen in water worden vervangen, kan een verbinding worden verkregen die bekend staat als zwaar water. De waterstof die in de oceaan aanwezig is en dat is in de vorm van deuterium het vertoont slechts een aandeel van 0,016% in verhouding tot protium. In het heelal heeft deze isotoop de neiging sneller samen te smelten en helium te vormen. Als we deuterium combineren met atomaire zuurstof, zien we dat het een giftige soort wordt. Ondanks dit, en de chemische eigenschappen of zeer vergelijkbaar met die van waterstof.
Een andere eigenschap van deze isotoop is dat wanneer deuteriumatomen bij hoge temperaturen aan het kernfusieproces worden onderworpen, er grote hoeveelheden energie vrijkomen. Het is de uittocht die je hebt bestudeerd om de kernfusie van onze planeet te kunnen implanteren. Enkele fysische eigenschappen zoals kookpunt, verdampingswarmte, tripelpunt en dichtheid ze zijn groter dan die van waterstof.
Ik hoop dat je met deze informatie meer te weten kunt komen over deuterium en zijn kenmerken.