
Después del conocido modelo atómico de Thomson, que consideraba que los electrones estaban en un medio con carga positiva, se desarrolló un modelo más avanzado conocido como modelo atómico de Rutherford. El científico a cargo de este nuevo avance para la ciencia era Ernest Rutherford. Nació el 20 de agosto de 1871 y murió el 19 de octubre de 1937. Durante su vida hizo grandes aportes a la química y al mundo de la ciencia en general.
Por ello, vamos a dedicar este artículo a contarte todo lo que debes saber sobre el modelo atómico de Rutherford.
Experimento de la Hoja de Oro
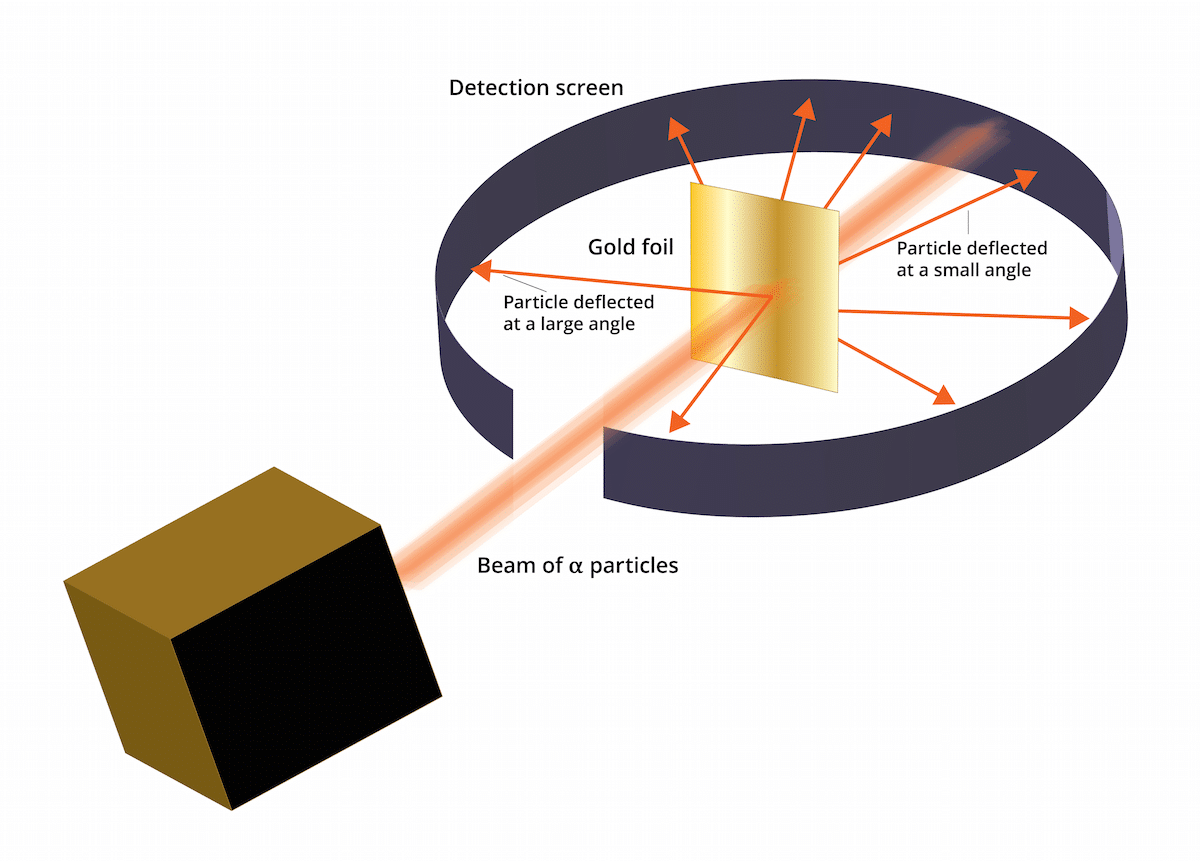
El antiguo modelo de thomson decía que los electrones estaban en un medio de carga positiva. En el año 1909 Ernest Rutherford acompañado con dos ayudantes llamados Geiger y Marsden hicieron un estudio conocido como experimento de la Hoja de Oro donde pudieron comprobar que el conocido » pudín con pasas» de Thomson estaba equivocado. Y es que este experimento nuevo pudo demostrar que el átomo tenía una estructura con una fuerte carga positiva. Este experimento o pudo ayudar a restablecer algunas conclusiones que terminaron presentándose como modelo atómico de Rutherford en el año 1911.
El experimento conocido como Hoja de Oro no fue único sino que se realizaron entre los años 1909 y el 1913. Para ello, utilizaron los laboratorios de física de la Universidad de Manchester. Estos experimentos tenían una gran importancia ya que de su resultados se pudieron establecer nuevas conclusiones que llegó a un revolucionario modelo atómico.
Esta experimento consistía lo siguiente: se debía de bombardear una lámina delgada de oro de tan sólo 100nm de espesor con gran cantidad de partículas alfa. Dichas partículas alfa eran y iones. Esto es, átomos que no tienen electrones, por lo que solamente tenían protones y neutrones. Al tener neutrones y protones la carga total del átomo era positiva. Esta experimento principalmente tenía el objetivo de corroborar si el modelo de Thomson era correcto. Si éste modelo tenía razón, las partículas alfa debían atravesar los átomos de oro en línea recta.
Para poder estudiar la deflexión que se causada por las partículas alfa es se tuvo de colocar un filtro fluorescente de sulfuro de zinc alrededor de la fina lámina de oro. El resultado de este experimento es que se pudo observar que algunas partículas eran capaces de atravesar los átomos de oro de la lámina en línea recta. Sin embargo, algunas de estas partículas alfa eran desviadas en direcciones aleatorias.
Conclusiones del experimento de la Hoja de Oro

Ante este hecho no se podía corroborar lo que los modelos atómicos anterior es considerada. Y es que estos modelos atómico señalaban que la carga positiva se distribuía de manera uniforme en los átomos y esto llevaría a que fuera más fácil atravesarla ya que su carga no sería tan fuerte en un punto determinado.
Los resultado de este experimento de la Hoja de Oro fue totalmente inesperado. Esto hizo que Rutherford pensara que el átomo tenía un centro con una fuerte carga positiva que hacía que cuando una partículas alfa intentara pasarla fuera rechazada por la estructura central. Para poder establecer una fuente más fiable se consideraron las partículas en cantidades de aquellas que fueron reflejadas y aquellas que no. Gracias a esta selección de partículas se pudo determinar el tamaño del núcleo comparado con la órbita de los electrones que hay a su alrededor. También se pudo concluir que la mayor parte del espacio de un átomo está vacío.
Se pudo ver, algunas partículas alfa fueron desviada por la lámina de oro. Algunas de ellas se desviaban tan solamente en ángulos muy pequeños. Esto ayudaba a concluir que la carga positiva en un átomo no está uniformemente distribuida. Es decir, la carga positiva se sitúa a en un átomo de forma concentrada en un volumen muy pequeño de espacio.
Fueron muy pocas las partículas alfa que se desviaron hacia atrás. Esta desviación señala como sigue dichas partículas pudieron haber rebotado. Gracias a todas estas consideraciones nuevas se pudo establecer el modelo atómico de Rutherford con nuevas ideas.
Modelo atómico de Rutherford

Vamos a estudiar cuáles son los principios del modelo atómico de Rutherford:
- Las partículas que tienen carga positiva dentro de un átomo están dispuestas en un volumen muy pequeño si la comparamos con el volumen total de dicho átomo.
- Casi toda la masa que tiene un átomo se encuentra en ese pequeño volumen mencionado. A esta masa interior se le llamo núcleo.
- Los electrones que tienen cargas negativas se encuentran girando alrededor del núcleo.
- Los electrones va girando altas velocidades cuando están alrededor del núcleo y lo hacen en trayectorias circulares. A estas trayectorias se le llamo órbitas. Más adelante se le conocen como orbitales.
- Tanto aquellos electrones que estaban cargados negativamente es como el propio núcleo del átomo con carga positiva se mantienen siempre unidos gracias a la fuerza de atracción electrostática.
Aceptación y limitaciones del modelo atómico de Rutherford
Como era de esperar este nuevo modelo vislumbró todo un nuevo panorama del átomo en el mundo científico. Gracias a este modelo atómico muchísimos científicos posteriores pudieran estudiar y determinar el número de electrones que tiene cada elemento de la tabla periódica. Además, se pudieron realizar nuevos descubrimientos que ayudan a explicar el funcionamiento de un átomo de la forma más sencilla.
Sin embargo, este modelo también tiene algunas limitaciones y errores. Aunque significó un gran avance en el mundo de la física, no eran ni un modelo perfecto ni completo. Y es que de acuerdo a las leyes de Newton y a un aspecto importante de las leyes de Maxwell, éste modelo no podía explicar ciertas cosas:
- No podía explicar cómo las cargas negativas eran capaces de mantenerse unidas en el núcleo. Según dice la tibia electrónica, en las cargas positivas se deben repeler.
- Otra contradicción era hacia las leyes fundamentales de la electrodinámica. Si se consideraba que los electrones que tenían carga positiva debían girar alrededor del núcleo, deberían emitir una radiación electromagnética. Al emitir esta radiación se consume día energía que había que los electrones colapsaran en el núcleo. Por ello, estriada modelo atómico no puede explicar la estabilidad que tiene el átomo.
Espero que con esta información puedan conocer más acerca del modelo atómico de Rutherford.