
Pc iepazans Tomsona atomu modelis, kas elektronus uzskatīja par pozitīvi lādētu vidi, modernāku modeli, kas pazīstams kā Rezerfordas atomu modelis. Zinātnieks, kurš bija atbildīgs par šo jauno zinātnes virzību, bija Ernests Rezerfords. Viņš dzimis 20. gada 1871. augustā un miris 19. gada 1937. oktobrī. Dzīves laikā viņš sniedza lielu ieguldījumu ķīmijā un zinātnes pasaulē kopumā.
Tāpēc mēs veltīsim šo rakstu, lai pastāstītu jums visu, kas jums jāzina par Rezerfordas atomu modeli.
Zelta lapu eksperiments
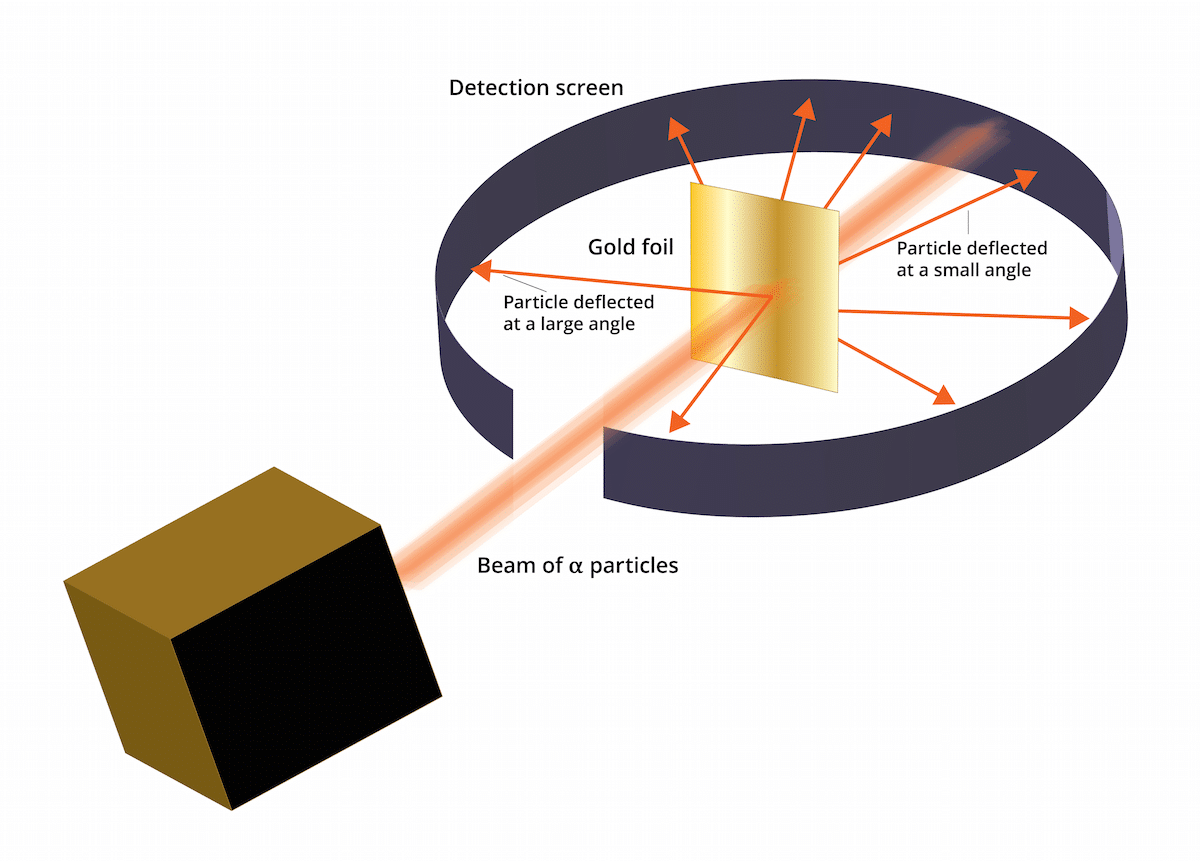
Vecais tomsona modelis teica, ka elektroni atrodas pozitīvi lādētā vidē. 1909. gadā Ernests Raterfords kopā ar diviem asistentiem Geigeru un Marsdenu veica pētījumu, kas pazīstams kā Zelta lapas eksperiments, kur viņi varēja pārliecināties Tomsona labi pazīstamais "rozīņu pudiņš" bija nepareizs. Un vai šis jaunais eksperiments spēja parādīt, ka atomam bija struktūra ar spēcīgu pozitīvu lādiņu. Šis eksperiments vai tas varētu palīdzēt atjaunot dažus secinājumus, kas galu galā tika parādīti kā Rezerforda atomu modelis 1911. gadā.
Eksperiments, kas pazīstams kā Zelta lapa, nebija unikāls, taču tas tika veikts laikā no 1909. līdz 1913. gadam. To viņi izmantoja Mančestras universitātes fizikas laboratorijas. Šiem eksperimentiem bija liela nozīme, jo no to rezultātiem varēja izdarīt jaunus secinājumus, kas noveda pie revolucionāra atomu modeļa.
Šis eksperiments sastāvēja no šādiem: plāna tikai 100 nm bieza zelta loksne bija jābombardē ar lielu daudzumu alfa daļiņu. Šīs alfa daļiņas bija un joni. Tas ir, atomiem, kuriem nav elektronu, tāpēc tiem bija tikai protoni un neitroni. Ar neitroniem un protoniem kopējais atoma lādiņš bija pozitīvs. Šī eksperimenta mērķis galvenokārt bija apstiprināt, vai Tomsona modelis ir pareizs. Ja šim modelim bija taisnība, alfa daļiņām bija jāiet cauri zelta atomiem taisnā līnijā.
Lai izpētītu alfa daļiņu izraisīto novirzi, ap smalko zelta foliju bija jānovieto fluorescējošs cinka sulfīda filtrs. Šī eksperimenta rezultāts ir tāds, ka tika novērots, ka dažas daļiņas spēja iziet cauri loksnes zelta atomiem taisnā līnijā. Tomēr dažas no šīm alfa daļiņām tika novirzītas nejaušos virzienos.
Zelta lapas eksperimenta secinājumi

Ņemot vērā šo faktu, nebija iespējams apstiprināt to, ko uzskata par iepriekšējiem atomu modeļiem. Un tas ir tas, ka šie atomu modeļi norādīja, ka pozitīvais lādiņš atomos tika sadalīts vienmērīgi, un tas atvieglotu tā šķērsošanu, jo tā lādiņš noteiktā brīdī nebūtu tik spēcīgs.
Šī zelta lapas eksperimenta rezultāti bija pilnīgi negaidīti. Tas Lutherfordam lika domāt, ka atomam ir centrs ar spēcīgu pozitīvu lādiņu, kas rodas, kad notiek alfa daļiņa mēģiniet to nodot, noraidot centrālo struktūru. Lai izveidotu ticamāku avotu, daļiņas tika ņemtas vērā daļās, kas bija atspoguļotas un kuras nebija. Pateicoties šai daļiņu atlasei, bija iespējams noteikt kodola lielumu, salīdzinot ar apkārt esošo elektronu orbītu. Varētu arī secināt, ka lielākā daļa atoma vietas ir tukša.
Varēja redzēt, ka dažas alfa daļiņas novirzīja zelta folija. Daži no viņiem novirzījās tikai ļoti mazos leņķos. Tas palīdzēja secināt, ka atoma pozitīvais lādiņš nav vienmērīgi sadalīts. Tas ir, pozitīvais lādiņš koncentrētā veidā atrodas uz atoma ļoti mazā kosmosa tilpumā.
Ļoti maz alfa daļiņu novirzījās atpakaļ. Šī novirze norāda, ka minētās daļiņas varētu būt atsitušās. Pateicoties visiem šiem jaunajiem apsvērumiem, Lutherforda atomu modeli varēja izveidot ar jaunām idejām.
Rezerforda atomu modelis

Mēs pētīsim, kādi ir Rutherford atomu modeļa principi:
- Daļiņas, kurām atoma iekšienē ir pozitīvs lādiņš tie ir sakārtoti ļoti mazā apjomā, ja salīdzinām to ar minētā atoma kopējo tilpumu.
- Gandrīz visa atoma masa ir tajā minētajā mazajā tilpumā. Šo iekšējo masu sauca par kodolu.
- Elektroni, kuriem ir negatīvs lādiņš ir atrodami rotējoši ap kodolu.
- Elektroni griežas lielā ātrumā, kad tie atrodas ap kodolu, un viņi to dara apļveida ceļos. Šīs trajektorijas sauca par orbītām. Vēlāk es to darīšu tās ir pazīstamas kā orbitāles.
- Gan tie elektroni, kas bija negatīvi uzlādēti, gan pozitīvi uzlādētā atoma kodols vienmēr tiek turēti kopā, pateicoties elektrostatiskās pievilkšanās spēkam.
Rezerforda atomu modeļa pieņemšana un ierobežojumi
Kā jau bija gaidāms, šis jaunais modelis paredzēja pilnīgi jaunu atoma panorāmu zinātnes pasaulē. Pateicoties šim atomu modelim, daudzi vēlāk zinātnieki varēja izpētīt un noteikt elektronu skaitu, kāds katram periodiskās tabulas elementam ir. Turklāt varētu veikt jaunus atklājumus, kas visvienkāršāk palīdz izskaidrot atoma darbību.
Tomēr šim modelim ir arī daži ierobežojumi un kļūdas. Lai arī tas bija izrāviens fizikas pasaulē, tie nebija ne ideāls, ne pilnīgs modelis. Un vai tas ir saskaņā ar Ņūtona likumiem un svarīgu Maksvela likumu aspektu, šis modelis nevarēja izskaidrot dažas lietas:
- Viņš nevarēja izskaidrot, kā negatīvie lādiņi spēja noturēties kopā kodolā. Saskaņā ar elektronisko stilba kaulu, pozitīvajiem lādiņiem jāatgrūž viens otru.
- Vēl viena pretruna bija par elektrodinamikas pamatlikumiem. Ja jāuzskata, ka elektroni ar pozitīvu lādiņu rotē ap kodolu, tiem vajadzētu izstarot elektromagnētisko starojumu. Izstarojot šo starojumu, tiek patērēta enerģija, lai elektroni sabruktu kodolā. Tāpēc svītrainais atomu modelis nevar izskaidrot atoma stabilitāti.
Es ceru, ka ar šo informāciju jūs varat uzzināt vairāk par Rezerforda atomu modeli.