
Protams, jūs kādreiz esat redzējis Bora atomu modelis. Tas ir diezgan svarīgs atklājums, ko šis zinātnieks izdarīja zinātnei, īpaši elektromagnētismam un elektroķīmijai. Iepriekš bija Rutherford modelis, kas bija diezgan revolucionārs un ļoti veiksmīgs, taču bija daži konflikti ar citiem atomu likumiem, piemēram, Maksvela un Ņūtona.
Šajā rakstā mēs jums pastāstīsim visu, kas jums jāzina par Bora atomu modeli, kā arī tā detaļas, lai noskaidrotu šaubas par šo tēmu.
Problēmas, kuras tas palīdzēja atrisināt
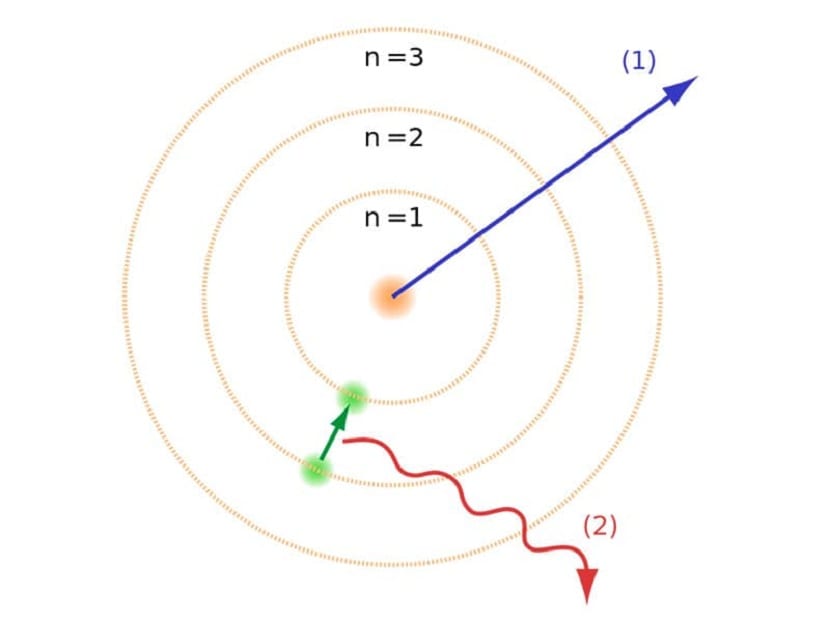
Kā mēs minējām raksta sākumā, šis atomu modelis palīdzēja atrisināt noteiktus konfliktus, kas pastāvēja ar citiem atomu likumiem. Iepriekšējā Rutherford modelī mums tas bija jādara elektroniem, kas pārvietojas ar negatīvu elektrisko lādiņu, bija jāizstaro elektromagnētiskā starojuma veids. Tas būtu jāpilda, pateicoties tur esošajiem elektromagnētisma likumiem. Šis enerģijas zudums izraisa elektronu samazināšanos līdz orbītā, spirāli virzoties uz centru. Nonākot centrā, viņi sabruka, saduroties ar serdi.
Tas teorētiski radīja problēmu, jo tā nevarēja sabrukt ar atomu kodolu, bet elektronu trajektorijai bija jābūt atšķirīgai. Tas tika atrisināts ar Bora atomu modeli. Tas to izskaidro elektroni riņķo ap kodolu dažās atļautajās orbītās, kurām ir noteikta enerģija. Enerģija ir proporcionāla Planka konstantei.
Šīs orbītas, kuras mēs esam minējuši, kur pārvietojas elektroni, sauca par enerģijas slāņiem vai enerģijas līmeņiem. Tas ir, enerģija, kas ir elektroniem, vienmēr nav vienāda, bet tiek kvantificēta. Kvantu līmeņi ir dažādas orbītas, kurās atrodami atomi. Atkarībā no tā, kurā orbītā tas atrodas jebkurā brīdī, tam būs vairāk vai mazāk enerģijas. Orbītā, kas atrodas tuvāk atoma kodolam, ir lielāks enerģijas daudzums. No otras puses, jo tālāk prom no kodola, jo mazāk enerģijas.
Enerģijas līmeņa modelis
Šis Bora atomu modelis, kas nozīmēja, ka elektroni var iegūt vai zaudēt enerģiju, tikai lecot no vienas orbītas uz otru, palīdzēja atrisināt Lutherforda modeļa piedāvāto sabrukumu. Pārejot no viena enerģijas līmeņa uz otru, tas absorbē vai izstaro elektromagnētisko starojumu. Tas ir, pārejot no vairāk uzlādēta enerģijas līmeņa uz mazāk uzlādētu, jūs atbrīvojat lieko enerģiju. Un otrādi, pārejot no zema enerģijas līmeņa uz augstāku, tas absorbē elektromagnētisko starojumu.
Tā kā šis atomu modelis ir Rezerforda modeļa modifikācija, tiek saglabātas mazā centrālā kodola īpašības un ar lielāko atoma masas daļu. Lai gan elektronu orbītas nav līdzenas kā planētām, varētu teikt, ka šie elektroni rotē ap savu kodolu līdzīgi kā planētas ap Sauli.
Bora atomu modeļa principi

Tagad mēs analizēsim šī atomu modeļa principus. Runa ir par detalizētu minētā modeļa un tā darbības izskaidrojumu.
- Daļiņas, kurām ir pozitīvs lādiņš To koncentrācija ir zema, salīdzinot ar kopējo atoma tilpumu.
- Elektroni ar negatīvu elektrisko lādiņu ir tie, kas tiek atrasti rotējoši ap kodolu apļveida enerģijas orbītās.
- Ir to orbītu enerģijas līmeņi, pa kuriem cirkulē elektroni. Viņiem ir arī noteikts lielums, tāpēc starp orbītām nav starpstāvokļa. Viņi vienkārši pāriet no viena līmeņa uz otru.
- Katras orbītas enerģija ir saistīta ar tās lielumu. Jo tālāk orbīta atrodas no atoma kodola, jo vairāk enerģijas tai ir.
- Enerģijas līmeņiem ir atšķirīgs elektronu skaits. Jo zemāks enerģijas līmenis, jo mazāk tajā ir elektronu. Piemēram, ja mēs esam pirmajā līmenī, būs līdz diviem elektroniem. 2. līmenī var būt līdz pat 8 elektroniem utt.
- Kad elektroni pārvietojas no vienas orbītas uz otru, tie absorbē vai atbrīvo elektromagnētisko enerģiju. Ja jūs pāriet no viena enerģētiskā līmeņa uz citu mazāk, jūs atbrīvojat lieko enerģiju un otrādi.
Šis modelis bija revolucionārs un mēģināja dot stabilitāti materiālam, kura iepriekšējiem modeļiem nebija. Ar šo atomu modeli tika izskaidroti arī gāzu diskrētie emisijas un absorbcijas spektri. Tas bija pirmais modelis, kas ieviesa kvantēšanas vai kvantēšanas jēdzienu. Tas padara Bora atomu modeli par modeli, kas atrodas pusceļā starp klasisko mehāniku un kvantu mehāniku. Lai arī tam ir arī trūkumi, tas bija priekšgājēja modelis Šrēdingera un citu zinātnieku vēlākai kvantu mehānikai.
Bora atomu modeļa ierobežojumi un kļūdas
Kā jau minējām, arī šim modelim ir noteikti trūkumi un kļūdas. Pirmkārt, tas nepaskaidro un nesniedz iemeslus, kāpēc elektroni jāierobežo tikai ar noteiktām orbītām. Tas tieši pieņem, ka elektroniem ir zināms rādiuss un orbīta. Tomēr tas tā nav. Desmit gadus vēlāk Heisenberga nenoteiktības princips to atspēkoja.
Lai gan šis atomu modelis spēja modelēt elektronu uzvedību ūdeņraža atomos, tas nebija tik precīzs, ja runa ir par elementiem ar lielāku elektronu skaitu. Tas ir modelis, kas ir grūtības izskaidrot Zēmana efektu. Šis efekts ir tas, ko var redzēt, kad ārējā un statiskā magnētiskā lauka klātbūtnē spektrālās līnijas tiek sadalītas divās vai vairāk.
Vēl viena no kļūdām un ierobežojumiem, kas piemīt šim modelim, ir tā, ka tas norāda nepareizu pamatstāvokļa orbītas leņķiskā impulsa vērtību. Visas šīs minētās kļūdas un ierobežojumi liek Bohra atomu modeli gadiem vēlāk aizstāt ar kvantu teoriju.
Es ceru, ka ar šo rakstu jūs varat uzzināt vairāk par Bora atomu modeli un tā pielietojumu zinātnē.