
Po pažinties Thomsono atominis modelis, kuri elektronus laikė teigiamai įkrautoje terpėje, pažangesnis modelis, žinomas kaip Rutherfordo atominis modelis. Už naują mokslo pažangą buvo atsakingas mokslininkas Ernestas Rutherfordas. Jis gimė 20 m. Rugpjūčio 1871 d. Ir mirė 19 m. Spalio 1937 d. Per savo gyvenimą jis labai prisidėjo prie chemijos ir mokslo pasaulio apskritai.
Todėl mes skirsime šį straipsnį, kad pasakytume viską, ką reikia žinoti apie Rutherfordo atominį modelį.
Aukso lapų eksperimentas
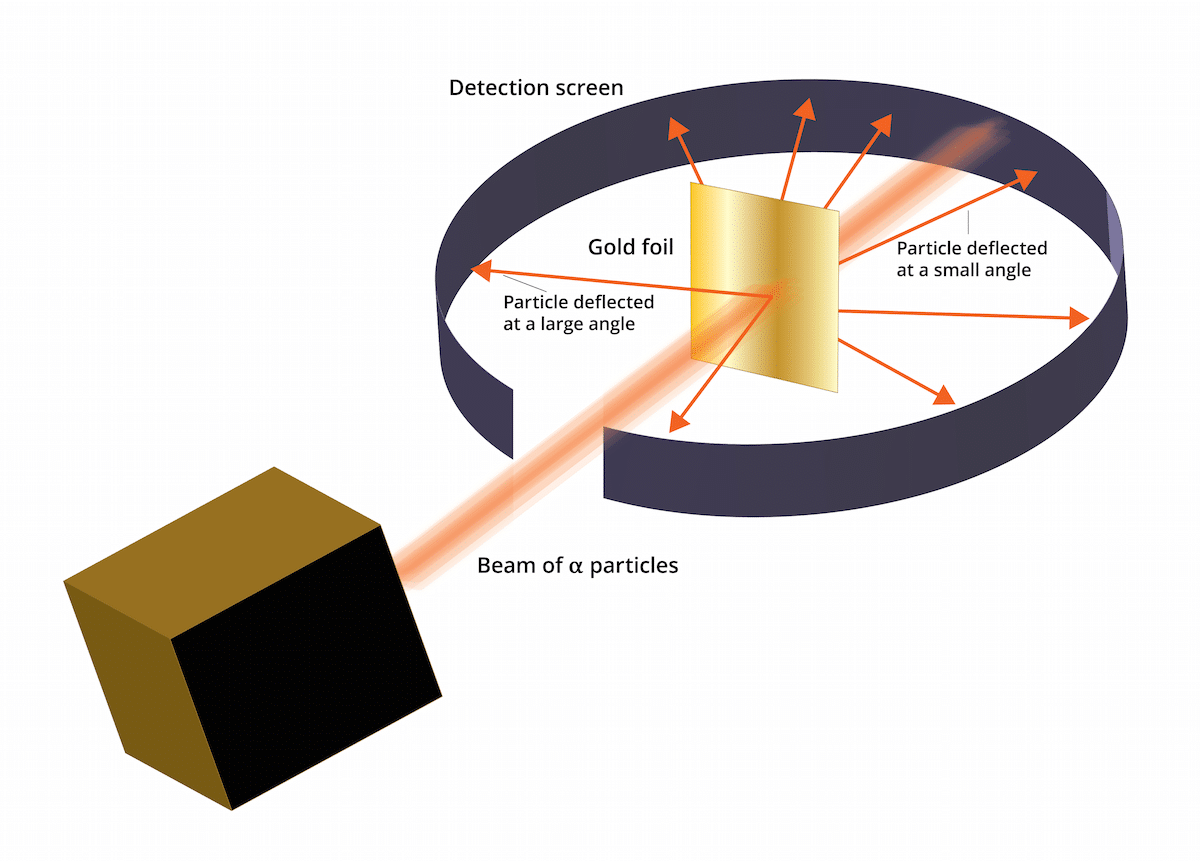
Senasis tomsono modelis teigė, kad elektronai yra teigiamai įkrautoje terpėje. 1909 m. Ernestas Rutherfordas, lydimas dviejų asistentų, pavadintų Geigeriu ir Marsdenu, atliko tyrimą, vadinamą aukso lapo eksperimentu, kuriame jie galėjo patikrinti Thomsono žinomas „razinų pudingas“ buvo neteisingas. Ir tai, kad šis naujas eksperimentas sugebėjo parodyti, kad atomas turėjo stiprų teigiamą krūvį. Šis eksperimentas arba galėtų padėti atkurti kai kurias išvadas, kurios 1911 m. Buvo pateiktos kaip Rutherfordo atominis modelis.
Eksperimentas, žinomas kaip Aukso lapas, nebuvo unikalus, tačiau jis buvo atliktas 1909–1913 m. Tam jie naudojo Mančesterio universiteto fizikos laboratorijos. Šie eksperimentai buvo labai svarbūs, nes iš jų rezultatų buvo galima padaryti naujas išvadas, pasiekusias revoliucinį atominį modelį.
Šį eksperimentą sudarė: ploną, tik 100 nm storio aukso lakštą reikėjo bombarduoti dideliu kiekiu alfa dalelių. Šios alfa dalelės buvo ir jonai. Tai yra, atomai, kurie neturi elektronų, todėl jie turėjo tik protonus ir neutronus. Turėdamas neutronus ir protonus, bendras atomo krūvis buvo teigiamas. Šio eksperimento tikslas buvo patvirtinti, ar Thomsono modelis buvo teisingas. Jei šis modelis buvo teisingas, alfa dalelės turėjo praeiti per aukso atomus tiesia linija.
Norint ištirti alfa dalelių sukeltą deformaciją, aplink smulkią aukso foliją reikėjo uždėti fluorescuojantį cinko sulfido filtrą. Šio eksperimento rezultatas yra tai, kad buvo galima pastebėti, jog kai kurios dalelės galėjo praeiti per auksinius lakšto atomus tiesia linija. Tačiau kai kurios iš šių alfa dalelių buvo nukreiptos atsitiktinėmis kryptimis.
„Aukso lapo“ eksperimento išvados

Atsižvelgiant į šį faktą, nebuvo įmanoma patvirtinti to, kas laikoma ankstesniais atominiais modeliais. Ir tai, kad šie atominiai modeliai nurodė, kad teigiamas krūvis pasiskirstė tolygiai atomuose, ir tai palengvintų jo perėjimą, nes jo krūvis tam tikru momentu nebūtų toks stiprus.
Šio „Gold Leaf“ eksperimento rezultatai buvo visiškai netikėti. Tai privertė Rutherfordą galvoti, kad atomas turi stiprų teigiamą krūvį turintį centrą, kurį sukuria alfa dalelė pabandykite jį perduoti atmesta centrinės struktūros. Norint nustatyti patikimesnį šaltinį, dalelės buvo svarstomos kiekiais tų, kurie atsispindėjo ir kurių nebuvo. Dėl tokio dalelių pasirinkimo buvo galima nustatyti branduolio dydį, palyginti su aplink jį esančių elektronų orbita. Taip pat galima daryti išvadą, kad didžioji atomo erdvės dalis yra tuščia.
Galima pastebėti, kad kai kurias alfa daleles nukreipė aukso folija. Kai kurie jų nukrypo tik labai mažais kampais. Tai padėjo padaryti išvadą, kad teigiamas atomo krūvis pasiskirsto netolygiai. Tai yra, teigiamas krūvis ant atomo yra koncentruotai, labai mažame erdvės tūryje.
Labai nedaug alfa dalelių atitolo atgal. Šis nuokrypis rodo, kad šios dalelės galėjo atsigauti. Visų šių naujų sumetimų dėka Rutherfordo atominis modelis galėtų būti sukurtas pasitelkus naujas idėjas.
Rutherfordo atominis modelis

Mes tirsime, kokie yra Rutherfordo atominio modelio principai:
- Dalelės, turinčios teigiamą krūvį atomo viduje jie yra išdėstyti labai mažu tūriu, jei palyginsime jį su bendru minėto atomo tūriu.
- Beveik visa atomo masė yra tame mažame minėtame tūryje. Ši vidinė masė buvo vadinama branduoliu.
- Elektronai, turintys neigiamą krūvį randama sukasi aplink branduolį.
- Elektronai sukasi dideliu greičiu, kai yra aplink branduolį, ir tai daro sukamaisiais keliais. Šios trajektorijos buvo vadinamos orbitomis. Vėliau padarysiu jie yra žinomi kaip orbitos.
- Tiek tie elektronai, kurie buvo neigiamai įkrauti, tiek paties teigiamai įkrauto atomo branduolys visada laikomi kartu dėl elektrostatinės traukos jėgos.
Rutherfordo atominio modelio priėmimas ir apribojimai
Kaip ir reikėjo tikėtis, šis naujas modelis numatė visiškai naują atomo panoramą mokslo pasaulyje. Dėl šio atominio modelio daugelis vėlesnių mokslininkų galėjo ištirti ir nustatyti elektronų skaičių, kurį turi kiekvienas periodinės lentelės elementas. Be to, būtų galima padaryti naujų atradimų, kurie paprasčiausiu būdu padeda paaiškinti atomo funkcionavimą.
Tačiau šis modelis taip pat turi tam tikrų apribojimų ir klaidų. Nors tai buvo lūžis fizikos pasaulyje, jie nebuvo nei tobulas, nei visiškas modelis. Ir tai yra pagal Niutono dėsnius ir svarbų Maksvelio dėsnių aspektą, šis modelis negalėjo paaiškinti tam tikrų dalykų:
- Jis negalėjo paaiškinti, kaip neigiami krūviai galėjo išlaikyti branduolį. Pagal elektroninį blauzdikaulį teigiami krūviai turi vienas kitą atstumti.
- Kitas prieštaravimas buvo susijęs su pagrindiniais elektrodinamikos dėsniais. Jei manoma, kad teigiamą krūvį turintys elektronai sukasi aplink branduolį, jie turėtų skleisti elektromagnetinę spinduliuotę. Skleidžiant šią spinduliuotę, sunaudojama energija, kad elektronai sugriūtų branduolyje. Todėl ruožuotas atominis modelis negali paaiškinti atomo stabilumo.
Tikiuosi, kad turėdami šią informaciją galite sužinoti daugiau apie Rutherfordo atominį modelį.