
La Ley de Boyle fue descubierta por Robert Boyle en el siglo XVII y sentó las bases para explicar la relación entre la presión y el volumen presente en los gases. A través de una serie de experimentos, logró demostrar que si la temperatura es constante, un gas reduce su volumen cuando se le somete a más presión, y aumenta de volumen si se reduce la presión.
En este artículo vamos a contarte todo lo que necesita saber sobre ley de Boyle, sus características e importancia.
Características principales
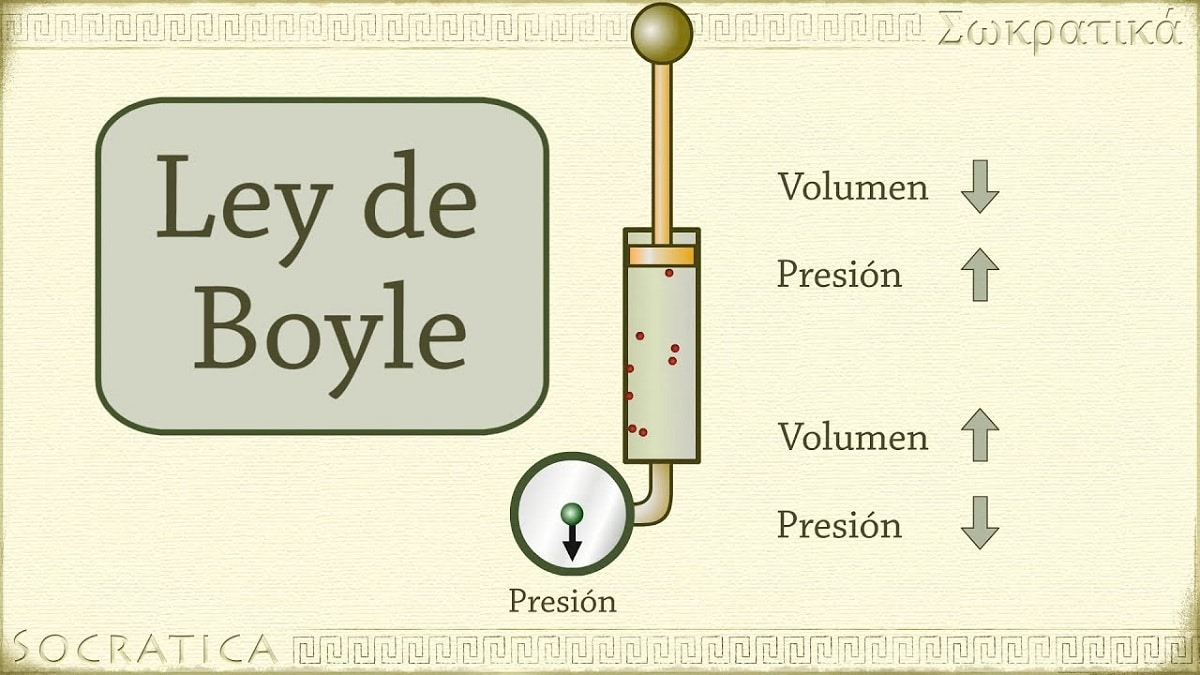
En 1662, Robert Boyle descubrió que la presión ejercida sobre un gas es inversamente proporcional a su volumen y número de moles a temperatura constante. En otras palabras, si se duplica la presión aplicada a un gas, el mismo gas se comprimirá y su volumen se reducirá a la mitad.
A medida que aumenta el volumen del recipiente que contiene el gas, también aumenta la distancia que deben recorrer las partículas antes de chocar con las paredes del recipiente. Este aumento en la distancia permite que la frecuencia de los choques disminuya, por lo que la presión sobre la pared es menor que antes cuando el volumen era menor.
La Ley de Boyle fue descubierta por primera vez en 1662 por Robert Boyle. Edme Mariotte fue otro científico que pensó y llegó a las mismas conclusiones que Boyle, sin embargo, Mariotte no hizo público su trabajo hasta 1676. Es por eso que en muchos libros encontramos esta ley denominada Ley de Boyle y Mariot Ley de Boyle-Mariot, también conocida como Ley de Mattut, desarrollada por el físico y químico británico Robert Fue formulada de manera independiente por Boyle y el físico y botánico francés Edmé Mattout.
Se refiere a una de las leyes que relacionan el volumen y la presión de un gas con una cierta cantidad de gas mantenida a una temperatura constante. La Ley de Boyle establece lo siguiente: La presión ejercida por una fuerza es físicamente inversamente proporcional al volumen de la materia gaseosa siempre que su temperatura permanezca constante. O más simplemente, podemos interpretarlo como: a una temperatura constante más alta, el volumen de una masa fija de gas es inversamente proporcional a la presión constante que ejerce.
Experimentos y aplicaciones de la ley de Boyle

Para probar la teoría de la Ley de Boyle, Mariot se encargó de introducir gas en un cilindro con pistón y logró comprobar las diferentes presiones que se creaban a medida que el pistón descendía. Se infiere de este experimento que a medida que aumenta el volumen, la presión disminuye.
La ley de Boyle tiene muchas aplicaciones en la vida moderna, entre las que podemos mencionar por ejemplo el buceo, esto se debe a que el buzo tiene que expulsar el aire de sus pulmones al ascender porque este se expande cuando la presión disminuye, si no lo hace puede causar daño al tejido.
Se encuentra en todos los equipos que utilizan o funcionan con energía neumática, como los brazos robóticos que utilizan componentes como pistones neumáticos, actuadores, reguladores de presión y válvulas de alivio de presión.
Los motores de gasolina, gas o diésel también utilizan la ley de Boyle durante la combustión interna, porque la primera vez que entra aire en el cilindro con volumen y presión, la segunda vez reduce el volumen al aumentar la presión.
Los automóviles cuentan con sistemas de bolsas de aire que funcionan expulsando una cierta cantidad de aire o gas desde una cámara que llega a la bolsa de aire exterior, donde la presión disminuye y el volumen aumenta manteniendo una temperatura constante.
La Ley de Boyle es muy importante hoy en día porque es la ley que nos habla y explica el comportamiento de los gases. Definitivamente explica que la presión y el volumen de un gas son inversamente proporcionales entre sí. Por lo tanto, cuando se aplica presión a un gas, su volumen disminuye y su presión aumenta.
Modelo de gas ideal

La ley de Boyle-Mariotte se aplica a los llamados gases ideales, un modelo teórico que simplifica enormemente el comportamiento de cualquier gas, suponiendo:
- Las moléculas de gas son tan pequeñas que no es necesario pensar en su tamaño, sobre todo teniendo en cuenta que este es mucho más pequeño que la distancia que recorren.
- Además, las moléculas apenas interactúan, excepto cuando chocan muy brevemente, y cuando lo hacen, el choque es elástico, por lo que se conservan tanto el momento como la energía cinética.
- Por último, supongamos que esta energía cinética es proporcional a la temperatura de la muestra gaseosa, es decir, cuanto más agitadas estén las partículas, mayor será la temperatura.
Los gases ligeros, independientemente de su identidad, siguen muy estrictamente estas pautas en condiciones estándar de temperatura y presión (es decir: 0ºC y presión atmosférica (1 atmósfera). Para estos gases, la ley de Boyle-Mariotte describe su comportamiento con mucha precisión.
Dado que P∙V es constante a una temperatura dada, si la presión del gas cambia, el volumen cambia de modo que el producto permanece igual, por lo que en dos estados diferentes 1 y 2, la igualdad se puede expresar de la siguiente manera:
P1∙V1 = P2∙V2
Luego, conociendo un estado, más una variable del otro estado, puede conocer la variable faltante eliminándola de la ley de Boyle-Mariot.
Historia de la ley de Boyle
Químico británico. Pionero de experimentos en el campo de la química, especialmente en las propiedades de los gases,
La tesis de Robert Boyle sobre el comportamiento de la materia a nivel de partículas fue un precursor de la teoría moderna de los elementos químicos. También fue miembro fundador de la Royal Society de Londres.
Robert Boyle nació en una familia noble en Irlanda y asistió a las mejores escuelas inglesas y europeas. De 1656 a 1668 se desempeñó como asistente de Robert Hooke en la Universidad de Oxford, colaborando con él en una serie de experimentos que determinaron las propiedades físicas del aire y cómo se quema, respira y transmite el sonido.
Los resultados de estas aportaciones quedaron recogidos en sus «Nuevos experimentos físico-mecánicos sobre la elasticidad del aire y sus efectos» (1660). En la segunda edición de esta obra (1662), reveló la famosa propiedad de los gases, la ley de Boyle-Mariotte, que establecía que el volumen que ocupa un gas a temperatura constante es inversamente proporcional a su presión. Hoy se sabe que esta ley se cumple solo cuando se acepta el comportamiento ideal teórico de los gases.
Espero que con esta información puedan conocer más sobre la ley del Boyle, sus características y aplicaciones en el mundo de la ciencia.