בתחום הפיזיקה, יש ענף האחראי על חקר התמורות שנוצרות על ידי חום ועבודה במערכת. זה קשור לתרמודינמיקה. זהו ענף פיזיקה שאחראי על חקר כל המעברים, שהם רק תוצאה של תהליך הכולל שינויים במשתני המצב של הטמפרטורה והאנרגיה ברמת המאקרו. יש כמה עקרונות התרמודינמיקה שהם בסיסיים להיבטים רבים של הפיזיקה.
לכן, אנו הולכים לספר לכם במאמר זה מהם עקרונות התרמודינמיקה ומה חשיבותה.
מאפיינים של תרמודינמיקה
אם ננתח את התרמודינמיקה הקלאסית, נגלה שהיא מבוססת על הרעיון של מערכות מקרוסקופיות. מערכת זו היא רק חלק מהאיכות הפיזית או הרעיונית של ההפרדה מהסביבה החיצונית. כדי ללמוד טוב יותר את המערכת התרמודינמית, תמיד מניחים שמדובר במסה פיזית היא אינה מופרעת מחילופי האנרגיה עם המערכת האקולוגית החיצונית.
מצבה של מערכת מקרוסקופית בשיווי משקל מצוין בכמויות הנקראות משתנים תרמודינמיים. אנו מכירים את כל המשתנים הללו: טמפרטורה, לחץ, נפח והרכב כימי. כל המשתנים הללו מגדירים את המערכת ואת שיווי המשקל שלה. הודות לברית היישומים הבינלאומית, נקבעו הסמלים העיקריים של התרמודינמיקה הכימית. שימוש ביחידות אלה יכול לעבוד טוב יותר ולהסביר את עקרונות התרמודינמיקה.
עם זאת, יש ענף של תרמודינמיקה שאינה חוקרת שיווי משקל, במקום זאת, הם אחראים על ניתוח תהליכים תרמודינמיים המתאפיינים בעיקר בכך שאין להם יכולת להשיג תנאי שיווי משקל בצורה יציבה.
עקרונות התרמודינמיקה
ישנם 4 עקרונות של תרמודינמיקה, המפורטים מאפס לשלוש נקודות, חוקים אלה עוזרים להבין את כל חוקי הפיזיקה ביקום שלנו ואי אפשר לראות תופעות מסוימות בעולמנו. הם ידועים גם בשם חוקי התרמודינמיקה. לחוקים אלה יש מקורות שונים. חלקם מנוסחים מנוסחאות קודמות. חוק התרמודינמיקה האחרון הידוע הוא חוק האפס. חוקים אלה הם קבועים בכל החקירות והחקירות המתבצעות במעבדה. הם חיוניים להבנת אופן פעולתו של היקום שלנו. נתאר את עקרונות התרמודינמיקה בזה אחר זה.
עיקרון ראשון
חוק זה אומר כי לא ניתן ליצור או להרוס אנרגיה, ניתן לשנותה בלבד. זה ידוע גם כחוק שימור האנרגיה. בעצם, המשמעות היא שבכל מערכת פיזית המבודדת מסביבתה, כל האנרגיה שלה תמיד תהיה זהה. למרות שניתן להמיר אנרגיה לסוגים אחרים של אנרגיה בצורה כזו או אחרת, סכום כל האנרגיות הללו תמיד זהה.
אנו ניתן דוגמה כדי להבין זאת טוב יותר. בעקבות עיקרון זה, אם אנו תורמים כמות מסוימת של אנרגיה למערכת פיזית בצורה של חום, נוכל לחשב את סך האנרגיה על ידי מציאת ההבדל בין הגידול באנרגיה הפנימית לבין העבודה הנעשית על ידי המערכת וסביבתה. כלומר, ההבדל בין האנרגיה שיש למערכת באותו רגע לבין העבודה שהיא ביצעה יהיה האנרגיה התרמית המשתחררת.
עיקרון שני
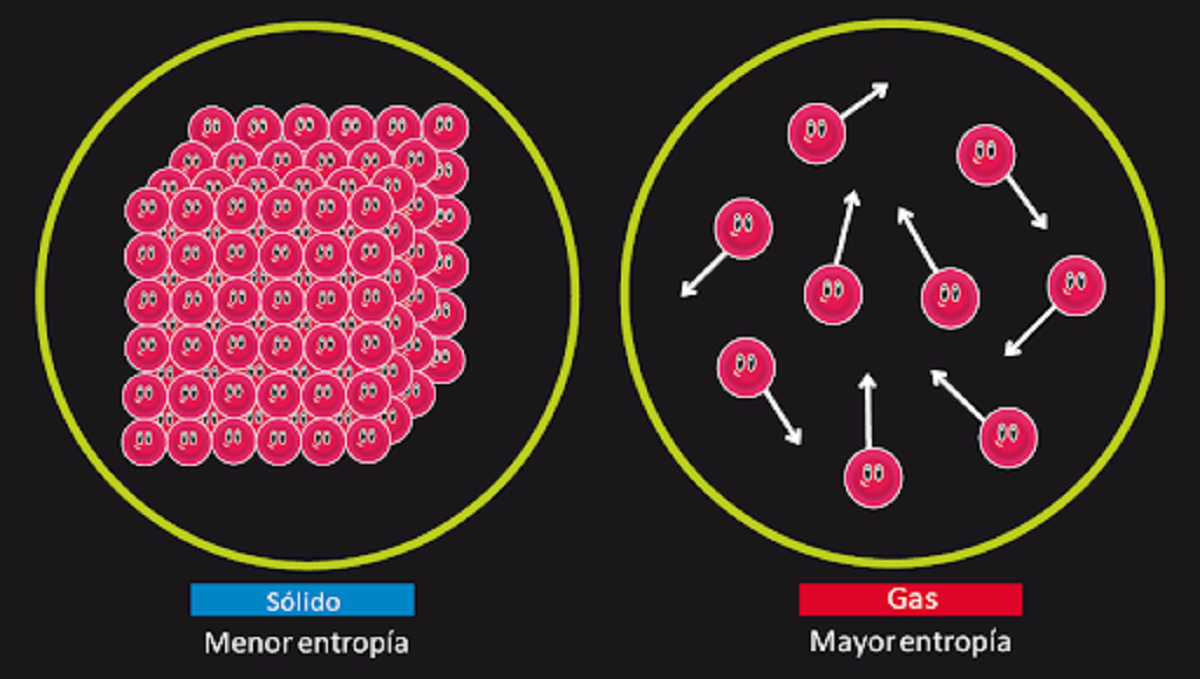
אם יש מספיק זמן, כל המערכות בסופו של דבר יאבדו את שיווי המשקל שלהן. עקרון זה נקרא גם חוק האנטרופיה. ניתן לסכם זאת כדלקמן. כמות האנטרופיה ביקום תגדל עם הזמן. האנטרופיה של המערכת היא מדד למדידת מידת ההפרעה. במילים אחרות, העיקרון השני של התרמודינמיקה אומר לנו שברגע שהמערכת מגיעה לנקודת שיווי משקל, זה יעלה את מידת ההפרעה במערכת. זה יכול להיות שאם נותנים למערכת מספיק זמן, היא בסופו של דבר תהפוך לאי -מאוזנת.
זהו החוק שאחראי להסביר את חוסר הפיכות של כמה תופעות פיזיות. לדוגמה, זה עוזר לנו להסביר מדוע נייר נייר שנשרף אינו יכול לחזור לצורתו המקורית. במערכת זו המכונה נייר ואש, אי סדר גדל עד כדי כך שלא ניתן לחזור למקורו. חוק זה מציג את פונקציית מצב האנטרופיה, אשר במקרה של מערכות פיזיקליות אחראית לייצג את מידת ההפרעה ואת אובדן האנרגיה הבלתי נמנע שלה.
כדי להבין את העיקרון השני של התרמודינמיקה נביא דוגמה. אם אנו שורפים כמות מסוימת של חומר ומחברים את הכדור יחד עם האפר המתקבל, אנו יכולים לראות שיש פחות חומר מאשר במצב ההתחלתי. הסיבה לכך היא שהחומר הפך לגזים לא ניתן לשחזר אותם והם צריכים להתפזר ולבלגן. כך אנו רואים שבמדינה אחת הייתה לפחות אנטרופיה מאשר במדינה השנייה.
עקרון שלישי
כאשר מגיעים לאפס מוחלט, תהליך המערכת הפיזית נעצר. אפס מוחלט הוא הטמפרטורה הנמוכה ביותר שאנו יכולים להגיע אליה. במקרה זה, אנו מודדים את הטמפרטורה במעלות קלווין. באופן זה ניתן לומר שטמפרטורה וקירור גורמים לאנטרופיה של המערכת להיות אפס. במקרים אלה, הוא דומה יותר לקבוע מובהק. כאשר הוא מגיע לאפס מוחלט, תהליך המערכת הפיזית נעצר. לכן לאנטרופיה יהיה ערך מינימלי אך קבוע.
להגיע לאפס מוחלט או לא זו משימה קלה. ערך האפס המוחלט של דרגת קלווין הוא אפס, אבל אם נשתמש בו מדידת סולם הטמפרטורות של צלזיוס, היא -273,15 מעלות.
חוק אפס
החוק הזה הוא האחרון הניח ואומר שאם A = C ו- B = C, אז A = B. זה קובע את הכללים הבסיסיים והבסיסיים של שלושת חוקי התרמודינמיקה האחרים. זהו שם המניח את חוק שיווי המשקל התרמי. במילים אחרות, אם המערכת ומערכות אחרות נמצאות באופן עצמאי בשיווי משקל תרמי, הן חייבות להיות בשיווי משקל תרמי. חוק זה מאפשר לקבוע עקרונות טמפרטורה. עקרון זה משמש להשוואת האנרגיה התרמית של שני עצמים שונים במצב של שיווי משקל תרמי. אם שני אובייקטים אלה נמצאים בשיווי משקל תרמי, הם יהיו ללא צורך באותה הטמפרטורה. מצד שני, אם שניהם ישנו את האיזון התרמי של המערכת השלישית, הם גם ישפיעו זה על זה.
אני מקווה שבעזרת מידע זה תוכל ללמוד עוד על עקרונות התרמודינמיקה של מאפייניו.