
Dopo la conoscenza Il modello atomico di Thomson, che considerava gli elettroni in un mezzo caricato positivamente, un modello più avanzato noto come Modello atomico di Rutherford. Lo scienziato responsabile di questo nuovo progresso per la scienza era Ernest Rutherford. Nacque il 20 agosto 1871 e morì il 19 ottobre 1937. Durante la sua vita diede grandi contributi alla chimica e al mondo della scienza in generale.
Pertanto, dedicheremo questo articolo per dirti tutto ciò che devi sapere sul modello atomico di Rutherford.
Esperimento con foglia d'oro
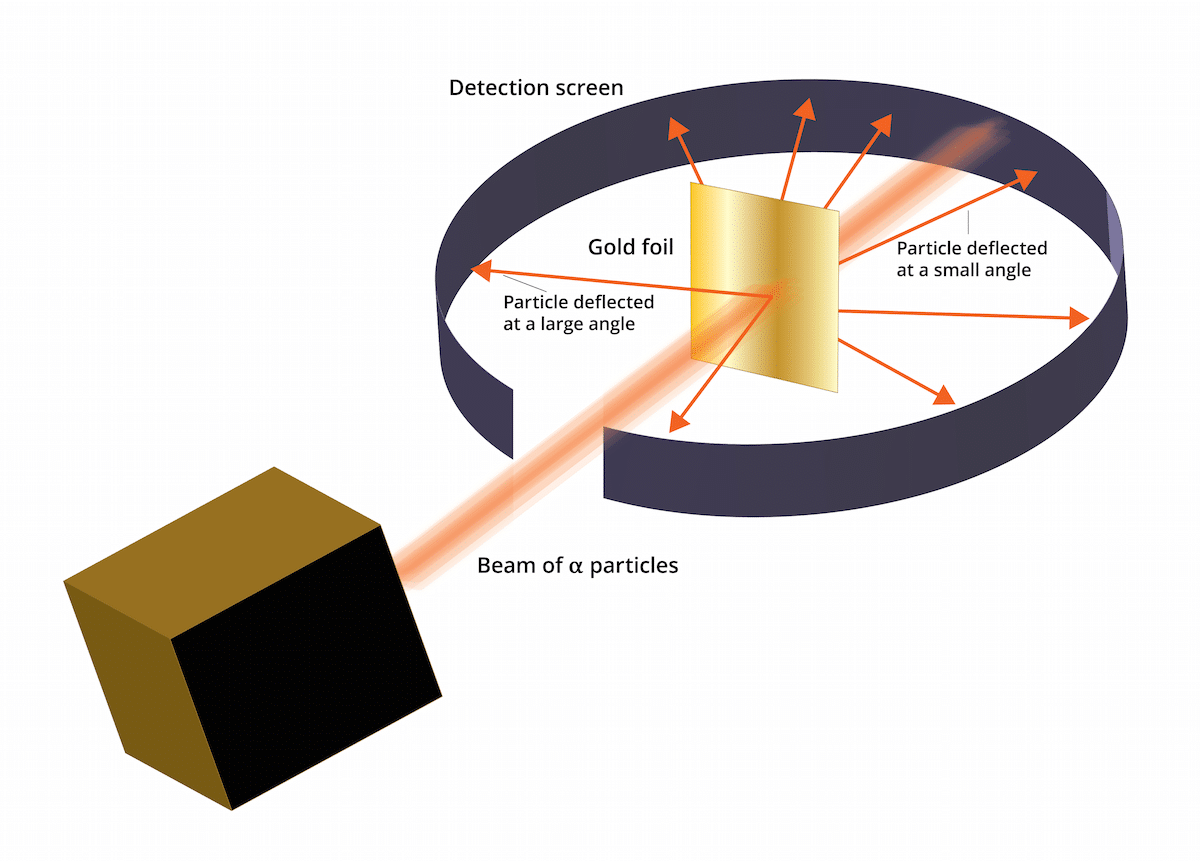
Il vecchio modello Thomson diceva che gli elettroni erano in un mezzo caricato positivamente. Nel 1909 Ernest Rutherford, accompagnato da due assistenti chiamati Geiger e Marsden, fece uno studio noto come esperimento Gold Leaf dove potevano verificare che Il famoso "budino di uva passa" di Thomson era sbagliato. Ed è che questo nuovo esperimento è stato in grado di dimostrare che l'atomo aveva una struttura con una forte carica positiva. Questo esperimento potrebbe aiutare a ristabilire alcune conclusioni che finirono per essere presentate come il modello atomico di Rutherford nel 1911.
L'esperimento noto come Foglia d'Oro non è stato unico ma è stato effettuato tra il 1909 e il 1913. Per questo, hanno usato i laboratori di fisica dell'Università di Manchester. Questi esperimenti erano di grande importanza poiché dai loro risultati si potevano stabilire nuove conclusioni che raggiungevano un modello atomico rivoluzionario.
Questo esperimento consisteva in quanto segue: un sottile foglio d'oro di soli 100 nm di spessore doveva essere bombardato con una grande quantità di particelle alfa. Queste particelle alfa erano e ioni. Cioè, atomi che non hanno elettroni, quindi avevano solo protoni e neutroni. Avendo neutroni e protoni, la carica totale dell'atomo era positiva. Questo esperimento aveva principalmente l'obiettivo di confermare se il modello Thomson fosse corretto. Se questo modello avesse ragione, le particelle alfa dovevano passare attraverso gli atomi d'oro in linea retta.
Per studiare la deflessione causata dalle particelle alfa, è stato necessario posizionare un filtro fluorescente al solfuro di zinco attorno alla lamina d'oro fine. Il risultato di questo esperimento è che è stato possibile osservare che alcune particelle erano in grado di passare attraverso gli atomi d'oro del foglio in linea retta. Tuttavia, alcune di queste particelle alfa sono state deviate in direzioni casuali.
Conclusioni dell'esperimento Gold Leaf

Dato questo fatto, non è stato possibile corroborare ciò che sono considerati i precedenti modelli atomici. Ed è che questi modelli atomici indicavano che la carica positiva era distribuita uniformemente negli atomi e questo avrebbe reso più facile attraversarla poiché la sua carica non sarebbe stata così forte a un certo punto.
I risultati di questo esperimento Gold Leaf sono stati totalmente inaspettati. Ciò ha fatto pensare a Rutherford che l'atomo avesse un centro con una forte carica positiva che ha prodotto una particella alfa prova a svenirlo rifiutato dalla struttura centrale. Per stabilire una fonte più affidabile, le particelle sono state considerate in quantità di quelle che erano riflesse e di quelle che non lo erano. Grazie a questa selezione di particelle è stato possibile determinare la dimensione del nucleo rispetto all'orbita degli elettroni che lo circondano. Si potrebbe anche concludere che la maggior parte dello spazio di un atomo è vuoto.
Si può vedere che alcune particelle alfa sono state deviate dalla lamina d'oro. Alcuni di loro hanno deviato solo ad angoli molto piccoli. Ciò ha contribuito a concludere che la carica positiva su un atomo non è distribuita uniformemente. Cioè, la carica positiva si trova su un atomo in modo concentrato in un volume molto piccolo di spazio.
Pochissime particelle alfa tornarono indietro. Questa deviazione indica come segue dette particelle potrebbero aver rimbalzato. Grazie a tutte queste nuove considerazioni, il modello atomico di Rutherford potrebbe essere stabilito con nuove idee.
Il modello atomico di Rutherford

Studieremo quali sono i principi del modello atomico di Rutherford:
- Particelle che hanno una carica positiva all'interno di un atomo sono disposti in un volume molto piccolo se lo confrontiamo con il volume totale di detto atomo.
- Quasi tutta la massa che ha un atomo è in quel piccolo volume menzionato. Questa massa interna era chiamata nucleo.
- Elettroni che hanno cariche negative si trovano in rotazione attorno al nucleo.
- Gli elettroni ruotano ad alta velocità quando sono intorno al nucleo e lo fanno in percorsi circolari. Queste traiettorie erano chiamate orbite. Più tardi lo farò sono conosciuti come orbitali.
- Sia quegli elettroni che erano caricati negativamente che il nucleo dello stesso atomo caricato positivamente sono sempre tenuti insieme grazie alla forza di attrazione elettrostatica.
Accettazione e limitazioni del modello atomico di Rutherford
Come previsto, questo nuovo modello prevedeva un panorama completamente nuovo dell'atomo nel mondo scientifico. Grazie a questo modello atomico, molti scienziati successivi potrebbero studiare e determinare il numero di elettroni che ha ogni elemento nella tavola periodica. Inoltre, si potrebbero fare nuove scoperte che aiutano a spiegare il funzionamento di un atomo nel modo più semplice.
Tuttavia, questo modello presenta anche alcune limitazioni e bug. Sebbene fosse una svolta nel mondo della fisica, non erano né un modello perfetto né completo. Ed è quello di secondo le leggi di Newton e un aspetto importante delle leggi di Maxwell, questo modello non poteva spiegare certe cose:
- Non riusciva a spiegare come le cariche negative potessero tenersi insieme nel nucleo. Secondo la tibia elettronica, le cariche positive devono respingersi a vicenda.
- Un'altra contraddizione era verso le leggi fondamentali dell'elettrodinamica. Se si considerasse che gli elettroni con una carica positiva ruotassero attorno al nucleo, dovrebbero emettere radiazioni elettromagnetiche. Quando si emette questa radiazione, l'energia viene consumata affinché gli elettroni collassino nel nucleo. Pertanto, il modello atomico striato non può spiegare la stabilità dell'atomo.
Spero che con queste informazioni possiate saperne di più sul modello atomico di Rutherford.