
Hai mai visto il file Modello atomico di Bohr. Questa è una scoperta piuttosto importante che questo scienziato ha fatto per la scienza, in particolare per l'elettromagnetismo e l'elettrochimica. In precedenza c'era il modello Rutherford, che era piuttosto rivoluzionario e con grande successo, ma c'erano alcuni conflitti con altre leggi atomiche come quella di Maxwell e Newton.
In questo articolo vi diremo tutto quello che c'è da sapere sul modello atomico di Bohr, così come i suoi dettagli per chiarire ogni dubbio sull'argomento.
Problemi che ha aiutato a risolvere
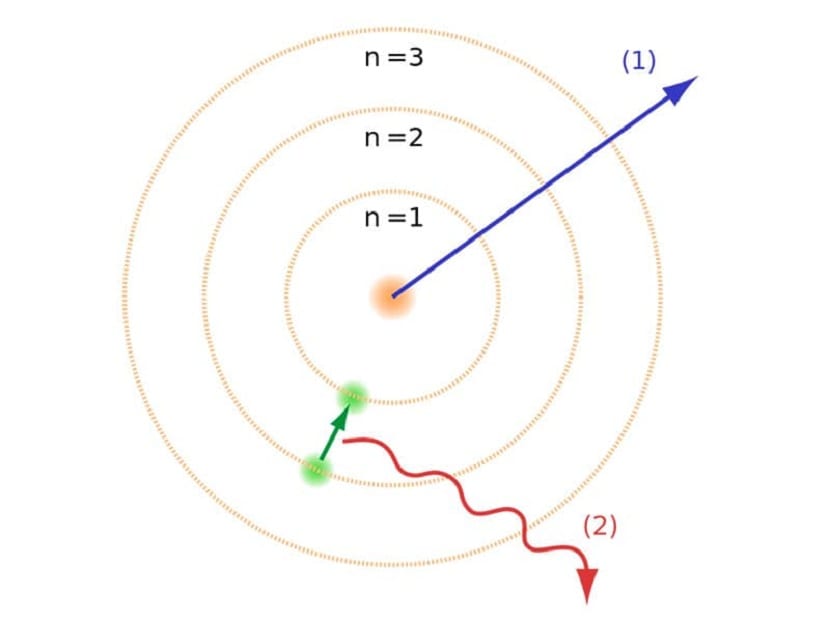
Come accennato all'inizio dell'articolo, questo modello atomico ha contribuito a risolvere alcuni conflitti esistenti con altre leggi atomiche. Nel precedente modello Rutherford, dovevamo gli elettroni che si muovevano con una carica elettrica negativa dovevano emettere un tipo di radiazione elettromagnetica. Questo dovrebbe essere soddisfatto a causa delle leggi dell'elettromagnetismo là fuori. Questa perdita di energia fa sì che gli elettroni vengano ridotti alla loro orbita ruotando a spirale verso il centro. Quando hanno raggiunto il centro sono collassati, scontrandosi con il nucleo.
Ciò ha generato un problema in teoria poiché non poteva collassare con il nucleo degli atomi, ma la traiettoria degli elettroni doveva essere diversa. Questo è stato risolto con il modello atomico di Bohr. Lo spiega gli elettroni orbitano attorno al nucleo in determinate orbite consentite e che hanno un'energia specifica. L'energia è proporzionale alla costante di Planck.
Queste orbite che abbiamo menzionato dove si muovono gli elettroni, sono state chiamate strati di energia o livelli di energia. Cioè, l'energia che gli elettroni possiedono non è sempre la stessa, ma è quantizzata. I livelli quantistici sono le diverse orbite in cui si trovano gli atomi. A seconda dell'orbita in cui si trova in un dato momento, avrà più o meno energia. Le orbite più vicine al nucleo dell'atomo hanno una maggiore quantità di energia. D'altra parte, più si allontanano dal nucleo, minore è l'energia.
Modello di livello energetico
Questo modello atomico di Bohr, che implicava che gli elettroni potessero guadagnare o perdere energia solo saltando da un'orbita all'altra, ha contribuito a risolvere il collasso proposto dal modello di Rutherford. Quando si passa da un livello di energia a un altro, assorbe o emette radiazioni elettromagnetiche. Cioè, quando salti da un livello di energia più carico a uno meno carico, rilasci l'energia in eccesso. Al contrario, quando passa da un livello di energia basso a uno più alto, assorbe la radiazione elettromagnetica.
Poiché questo modello atomico è una modifica del modello di Rutherford, le caratteristiche del piccolo nucleo centrale e con la maggior parte della massa dell'atomo vengono mantenute. Sebbene le orbite degli elettroni non siano piatte come quelle dei pianeti, si potrebbe dire che questi elettroni ruotano attorno al loro nucleo in modo simile ai pianeti intorno al Sole.
Principi del modello atomico di Bohr

Analizzeremo ora i principi di questo modello atomico. Si tratta di una spiegazione dettagliata di detto modello e del suo funzionamento.
- Particelle che hanno una carica positiva Sono a bassa concentrazione rispetto al volume totale dell'atomo.
- Gli elettroni con una carica elettrica negativa sono quelli che si trovano ruotando attorno al nucleo in orbite circolari di energia.
- Esistono livelli di energia delle orbite attraverso le quali circolano gli elettroni. Hanno anche una dimensione impostata, quindi non esiste uno stato intermedio tra le orbite. Passano semplicemente da un livello all'altro.
- L'energia che possiede ciascuna orbita è correlata alla sua dimensione. Più l'orbita è lontana dal nucleo dell'atomo, più energia ha.
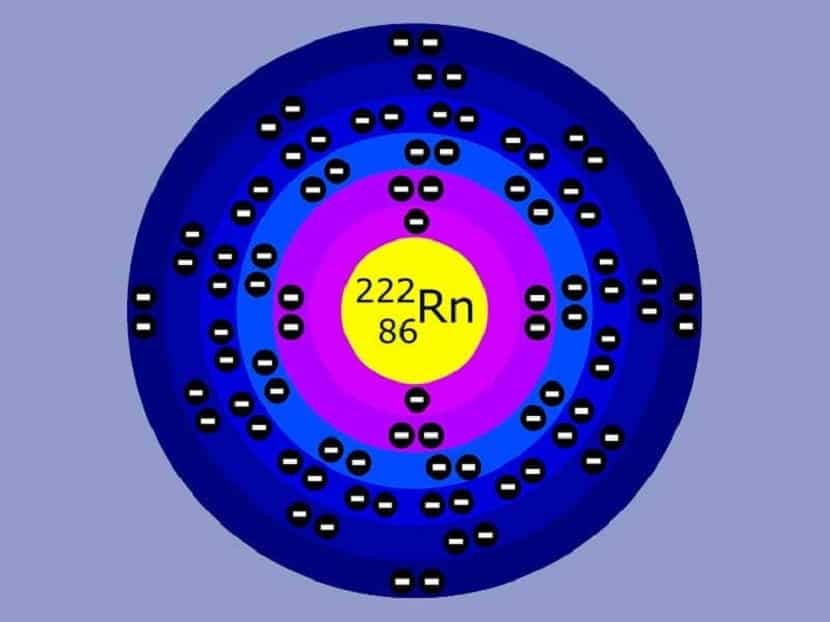
- I livelli di energia hanno un numero diverso di elettroni. Più basso è il livello di energia, meno elettroni contiene. Ad esempio, se siamo al livello uno, ci saranno fino a due elettroni. Al livello 2 possono esserci fino a 8 elettroni, così via.
- Quando gli elettroni si spostano da un'orbita all'altra, assorbono o rilasciano energia elettromagnetica. Se passi da un livello di energia in più a un altro in meno, rilasci l'energia rimasta e viceversa.
Questo modello era rivoluzionario e cercava di dare una stabilità al materiale che i modelli precedenti non avevano. Anche gli spettri discreti di emissione e assorbimento dei gas sono stati spiegati con questo modello atomico. È stato il primo modello che ha introdotto il concetto di quantizzazione o quantizzazione. Ciò rende il modello atomico di Bohr un modello a metà strada tra la meccanica classica e la meccanica quantistica. Sebbene abbia anche dei difetti, è stato un modello precursore per la successiva meccanica quantistica di Schrödinger e altri scienziati.
Limitazioni ed errori del modello atomico di Bohr
Come abbiamo accennato, questo modello presenta anche alcuni difetti ed errori. Prima di tutto, non spiega né fornisce ragioni per cui gli elettroni dovrebbero essere limitati solo a orbite specifiche. Assume direttamente che gli elettroni abbiano un raggio e un'orbita noti. Tuttavia, non è così. Un decennio dopo Il principio di indeterminazione di Heisenberg lo ha smentito.
Sebbene questo modello atomico fosse in grado di modellare il comportamento degli elettroni negli atomi di idrogeno, non era così esatto quando si trattava di elementi con un numero maggiore di elettroni. È un modello quello ha problemi a spiegare l'effetto Zeeman. Questo effetto è quello che si può osservare quando le righe spettrali sono divise in due o più in presenza di un campo magnetico esterno e statico.
Un altro degli errori e dei limiti di questo modello è che fornisce un valore errato per il momento angolare dell'orbita dello stato fondamentale. Tutti questi errori e limitazioni menzionati fanno sì che il modello atomico di Bohr sia stato sostituito anni dopo dalla teoria quantistica.
Spero che con questo articolo possiate saperne di più sul modello atomico di Bohr e sulle sue applicazioni nella scienza.