
La Legge di Boyle fu scoperto da Robert Boyle nel XVII secolo e gettò le basi per spiegare la relazione tra pressione e volume presente nei gas. Attraverso una serie di esperimenti, è riuscito a dimostrare che se la temperatura è costante, un gas riduce il suo volume quando è sottoposto a una pressione maggiore e aumenta di volume se la pressione viene ridotta.
In questo articolo ti diremo tutto ciò che devi sapere sulla legge di Boyle, le sue caratteristiche e l'importanza.
caratteristiche principali
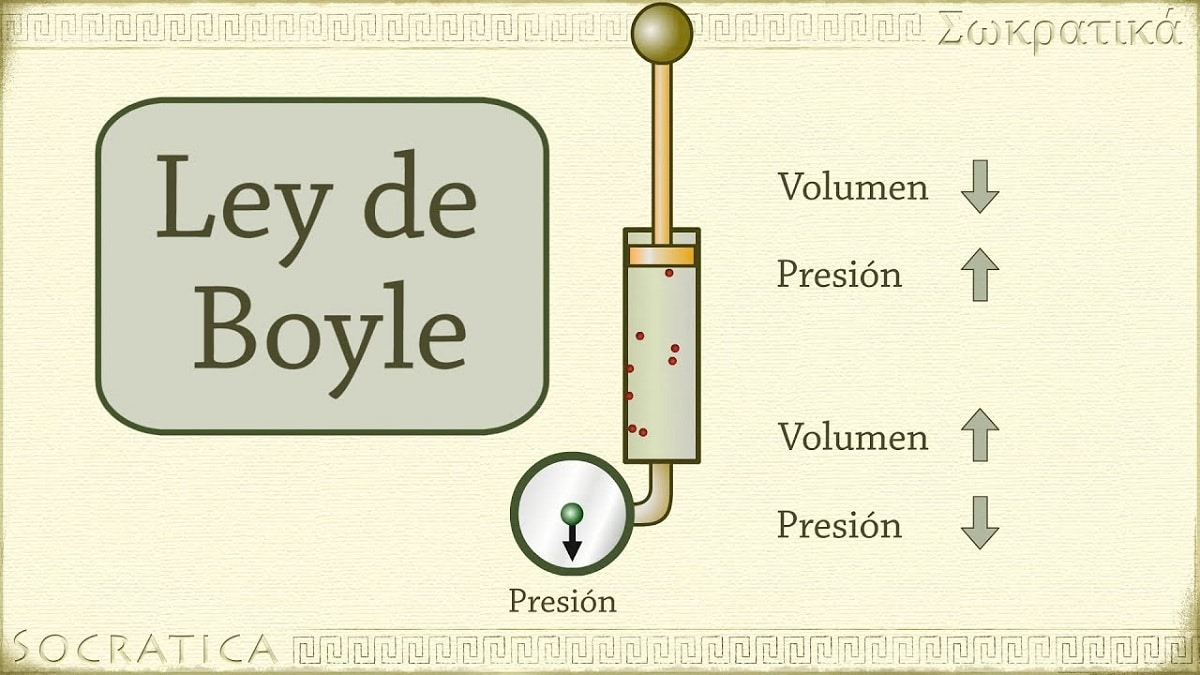
Nel 1662 Robert Boyle scoprì che la pressione esercitata su un gas è inversamente proporzionale al suo volume e al numero di moli a temperatura costante. In altre parole, se la pressione applicata a un gas è raddoppiata, lo stesso gas verrà compresso e il suo volume sarà dimezzato.
All'aumentare del volume del contenitore contenente il gas, aumenta anche la distanza che le particelle devono percorrere prima di entrare in collisione con le pareti del contenitore. Questo aumento della distanza consente alla frequenza degli urti di diminuire, quindi la pressione sulla parete è inferiore rispetto a prima quando il volume era inferiore.
La legge di Boyle fu scoperta per la prima volta nel 1662 da Robert Boyle. Edme Mariotte era un altro scienziato che pensava e giunse alle stesse conclusioni di Boyle, tuttavia, Mariotte non rese pubbliche le sue opere fino al 1676. Ecco perché in molti libri troviamo questa legge chiamata Boyle e la legge di Mariot Boyle-Mariot's Law, nota anche come legge di Mattut, sviluppata dal fisico e chimico britannico Robert È stata formulata indipendentemente da Boyle e dal fisico e botanico francese Edmé Mattout.
Si riferisce a una delle leggi che mettono in relazione il volume e la pressione di un gas con una certa quantità di gas mantenuta a temperatura costante. La legge di Boyle afferma quanto segue: la pressione esercitata da una forza è fisicamente inversamente proporzionale al volume della materia gassosa fintanto che la sua temperatura rimane costante. O più semplicemente, possiamo interpretarlo come: a una temperatura costante più elevata, il volume di una massa fissa di gas è inversamente proporzionale alla pressione costante che essa esercita.
Esperimenti e applicazioni della legge di Boyle

Per provare la teoria della legge di Boyle, Mariot era incaricato di introdurre il gas in un cilindro con un pistone e poteva verificare le diverse pressioni che si creavano durante la discesa del pistone. Da questo esperimento si deduce che all'aumentare del volume, la pressione diminuisce.
La legge di Boyle ha molte applicazioni nella vita moderna, tra le quali possiamo citare ad esempio l'immersione, questo perché il subacqueo deve espellere l'aria dai suoi polmoni quando sale perché si espande quando la pressione diminuisce, altrimenti può causare danni ai tessuti.
Si trova in tutte le apparecchiature che utilizzano o sono alimentate da alimentazione pneumatica, come i bracci robotici che utilizzano componenti come pistoni pneumatici, attuatori, regolatori di pressione e valvole limitatrici di pressione.
Anche i motori a benzina, gas o diesel utilizzano la legge di Boyle durante la combustione interna, perché la prima volta che l'aria entra nel cilindro con volume e pressione, la seconda volta riduce il volume aumentando la pressione.
Le auto hanno sistemi di airbag che funzionano espellendo una certa quantità di aria o gas da una camera che raggiunge l'airbag esterno, dove la pressione diminuisce e il volume aumenta mantenendo una temperatura costante.
La legge di Boyle è molto importante oggi perché è la legge che ci parla e spiega il comportamento dei gas. Spiega definitivamente che la pressione e il volume di un gas sono inversamente proporzionali tra loro. Pertanto, quando si applica pressione a un gas, il suo volume diminuisce e la sua pressione aumenta.
modello del gas ideale

Ai cosiddetti gas ideali si applica la legge di Boyle-Mariotte, un modello teorico che semplifica notevolmente il comportamento di qualsiasi gas, assumendo:
- molecole di gas sono così piccoli che non è necessario pensare alle loro dimensioni, soprattutto considerando che questo è molto più piccolo della distanza che percorrono.
- Inoltre, le molecole interagiscono a malapena, tranne quando si scontrano molto brevemente, e quando lo fanno, la collisione è elastica, quindi si conservano sia la quantità di moto che l'energia cinetica.
- Supponiamo infine che questa energia cinetica sia proporzionale alla temperatura del campione gassoso, cioè più agitate sono le particelle, maggiore è la temperatura.
I gas leggeri, indipendentemente dalla loro identità, seguono queste linee guida molto rigorosamente in condizioni standard di temperatura e pressione (es: 0ºC e pressione atmosferica (1 atmosfera). Per questi gas, la legge di Boyle-Mariotte ne descrive il comportamento in modo molto preciso. .
Poiché P∙V è costante ad una data temperatura, se la pressione del gas cambia, il volume cambia in modo che il prodotto rimanga lo stesso, quindi in due diversi stati 1 e 2, l'uguaglianza può essere espressa come segue:
P1∙V1 = P2∙V2
Quindi conoscendo uno stato, più una variabile dell'altro stato, puoi conoscere la variabile mancante rimuovendola dalla legge di Boyle-Mariot.
Storia della legge di Boyle
chimico britannico. Pioniere degli esperimenti nel campo della chimica, in particolare nelle proprietà dei gas,
La tesi di Robert Boyle sul comportamento della materia a livello di particelle è stata un precursore della moderna teoria degli elementi chimici. Fu anche membro fondatore della Royal Society di Londra.
Robert Boyle è nato in una famiglia nobile in Irlanda e ha frequentato le migliori scuole inglesi ed europee. Dal 1656 al 1668 prestò servizio come assistente di Robert Hooke all'Università di Oxford, collaborando con lui a una serie di esperimenti che determinarono le proprietà fisiche dell'aria e il modo in cui brucia, respira e trasmette il suono.
I risultati di questi contributi sono stati raccolti nel loro «Nuove sperimentazioni fisico-meccaniche sull'elasticità dell'aria ei suoi effetti» (1660). Nella seconda edizione di quest'opera (1662), rivelò la famosa proprietà dei gas, la legge di Boyle-Mariotte, che affermava che il volume occupato da un gas a temperatura costante è inversamente proporzionale alla sua pressione. Oggi è noto che questa legge si realizza solo quando viene accettato il comportamento ideale teorico dei gas.
Spero che con queste informazioni possiate saperne di più sulla legge di Boyle, le sue caratteristiche e le sue applicazioni nel mondo della scienza.