
Biztosan láttad már Bohr atommodell. Ez elég fontos felfedezés, amelyet ez a tudós a tudomány, különösen az elektromágnesesség és az elektrokémia számára tett. Korábban volt Rutherford modellje, amely meglehetősen forradalmi és nagyon sikeres volt, de voltak olyan ellentétek más atomtörvényekkel, mint például Maxwell és Newton.
Ebben a cikkben mindent elmondunk neked, amit tudnod kell Bohr atommodelljéről, valamint annak részleteiről, hogy tisztázzuk a témával kapcsolatos kétségeket.
Problémák, amelyek segítettek megoldani
Amint azt a cikk elején említettük, ez az atommodell segített megoldani bizonyos konfliktusokat, amelyek más atomtörvényekkel fennálltak. Az előző Rutherford modellben muszáj volt a negatív elektromos töltéssel mozgó elektronoknak egyfajta elektromágneses sugárzást kellett kibocsátaniuk. Ennek az elektromágnesesség törvényei miatt kell teljesülnie. Ez az energiaveszteség azt eredményezi, hogy az elektronok pályájukra redukálódnak a központ felé vezető spirál segítségével. Amikor a központba értek, összeomlottak, és összeütköztek a maggal.
Ez elméleti problémát vetett fel, mivel nem omlott össze az atomok magjával, de az elektronok pályájának másnak kellett lennie. Ezt a Bohr atommodellel oldották meg. Ezt megmagyarázza az elektronok a megengedett és meghatározott energiájú pályákon a mag körül keringenek. Az energia arányos Planck állandójával.
Ezeket a pályákat, amelyeket említettünk, ahol az elektronok mozognak, energiarétegeknek vagy energiaszinteknek neveztük. Vagyis az elektronok energiája nem mindig ugyanaz, hanem kvantált. A kvantumszintek azok a különböző pályák, amelyekben atomok találhatók. Attól függően, hogy melyik pályán van az adott pillanatban, többé-kevésbé energiája lesz. Az atom magjához közelebb eső pályákon nagyobb az energiamennyiség. Másrészt minél távolabb van a magtól, annál kevesebb energia van.
Energiaszint modell
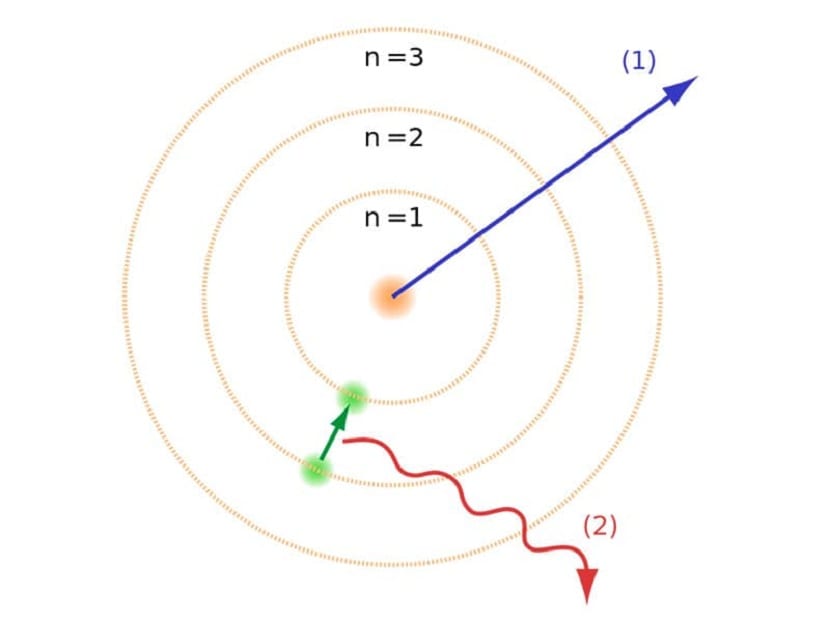
Ez a Bohr-atommodell, amely arra utalt, hogy az elektronok csak akkor tudnak energiát szerezni vagy veszíteni, ha egyik pályáról a másikra ugranak, segített megoldani a Rutherford-modell által javasolt összeomlást. Az egyik energiaszintről a másikra történő eljutáskor elnyeli vagy kibocsátja az elektromágneses sugárzást. Vagyis amikor egy feltöltött energiaszintről egy kevésbé feltöltöttre ugrik, felszabadítja a felesleges energiát. Ezzel szemben, ha alacsony energiaszintről magasabbra megy, elnyeli az elektromágneses sugárzást.
Mivel ez az atommodell a Rutherford-modell módosítása, a kis központi mag jellemzői és az atom tömegének legnagyobb része megmarad. Bár az elektronok keringése nem sík, mint a bolygóké, elmondható, hogy ezek az elektronok a magjuk körül hasonló módon forognak, mint a bolygók a Nap körül.
Bohr atommodell alapelvei

Most ennek az atommodellnek az alapelveit fogjuk elemezni. Az említett modell és működésének részletes magyarázatáról van szó.
- Pozitív töltésű részecskék Alacsony koncentrációban vannak az atom teljes térfogatához képest.
- Negatív elektromos töltéssel rendelkező elektronok azok, amelyek a mag körül keringő energiapályákon forognak.
- Vannak a pályák energiaszintjei, amelyeken keresztül az elektronok keringenek. Beállított méretük is van, így a pályák között nincs köztes állapot. Csak egyik szintről a másikra mennek.
- Az egyes pályák által birtokolt energia összefügg a méretével. Minél tovább van a pálya az atom magjától, annál több energiája van.
- Az energiaszintek különböző elektronszámmal rendelkeznek. Minél alacsonyabb az energiaszint, annál kevesebb elektron van benne. Például, ha az első szinten vagyunk, legfeljebb két elektron lesz. A 2. szinten akár 8 elektron is lehet, így tovább.
- Amikor az elektronok egyik pályáról a másikra mozognak, elnyelik vagy felszabadítják az elektromágneses energiát. Ha egy energikusabb szintről kevesebbre megy a másikra, felszabadítja a felesleges energiát és fordítva.
Ez a modell forradalmi volt, és igyekezett stabilitást adni annak az anyagnak, amellyel a korábbi modellek nem rendelkeztek. A gázok diszkrét emissziós és abszorpciós spektrumát szintén ezzel az atommodellel magyaráztuk. Ez volt az első modell, amely bevezette a kvantálás vagy a kvantálás fogalmát. Ez Bohr atommodelljévé teszi a modellt, amely félúton áll a klasszikus mechanika és a kvantummechanika között. Bár szintén hiányzik, Schrödinger és más tudósok későbbi kvantummechanikájának elődmodellje volt.
A Bohr atommodell korlátai és hibái
Mint említettük, ennek a modellnek is vannak bizonyos hiányosságai és hibái. Először is, nem magyarázza meg és nem indokolja, hogy az elektronokat miért kell csak meghatározott pályákra korlátozni. Közvetlenül azt feltételezi, hogy az elektronok sugara és keringése ismert. Ez azonban nem így van. Egy évtizeddel később Heisenberg bizonytalansági elve ezt cáfolta.
Bár ez az atommodell képes volt modellezni az elektronok viselkedését a hidrogénatomokban, nem volt olyan pontos, ha nagyobb elektronszámú elemekről van szó. Ez egy modell, amely gondjai vannak a Zeeman-effektus magyarázatával. Ez a hatás az, amit akkor láthatunk, amikor a spektrális vonalak két vagy több részre oszlanak egy külső és statikus mágneses mező jelenlétében.
A modell másik hibája és korlátozása az, hogy helytelen értéket ad az alapállapot pályájának szögmomentumához. Mindezen említett hibák és korlátozások arra engednek következtetni, hogy Bohr atommodellét évekkel később a kvantumelmélet váltotta fel.
Remélem, hogy ezzel a cikkel többet megtudhat Bohr atommodelljéről és a tudományban való alkalmazásáról.