
Jeste li ikad vidjeli Bohrov atomski model. Ovo je prilično važno otkriće koje je ovaj znanstvenik napravio za znanost, posebno za elektromagnetizam i elektrokemiju. Prije je postojao Rutherfordov model, koji je bio prilično revolucionaran i s velikim uspjehom, ali bilo je sukoba s drugim atomskim zakonima poput Maxwellovog i Newtonovog.
U ovom ćemo vam članku reći sve što trebate znati o Bohrovom atomskom modelu, kao i njegove detalje kako bismo razjasnili sve sumnje u vezi s tom temom.
Problemi koje je pomoglo riješiti
Kao što smo spomenuli na početku članka, ovaj je atomski model pomogao riješiti određene sukobe koji su postojali s drugim atomskim zakonima. U prethodnom Rutherfordovom modelu morali smo elektroni koji se kreću s negativnim električnim nabojem morali su emitirati vrstu elektromagnetskog zračenja. To bi trebalo biti ispunjeno zbog zakona elektromagnetizma tamo. Ovaj gubitak energije dovodi do smanjenja elektrona do njihove orbite spiralno prema središtu. Kad su došli do središta, srušili su se, sudarajući se s jezgrom.
To je stvorilo problem u teoriji, jer se nije moglo srušiti s jezgrom atoma, ali putanja elektrona morala je biti drugačija. To je riješeno Bohrovim atomskim modelom. To objašnjava elektroni kruže oko jezgre u određenim dozvoljenim putanjama koje imaju specifičnu energiju. Energija je proporcionalna Planckovoj konstanti.
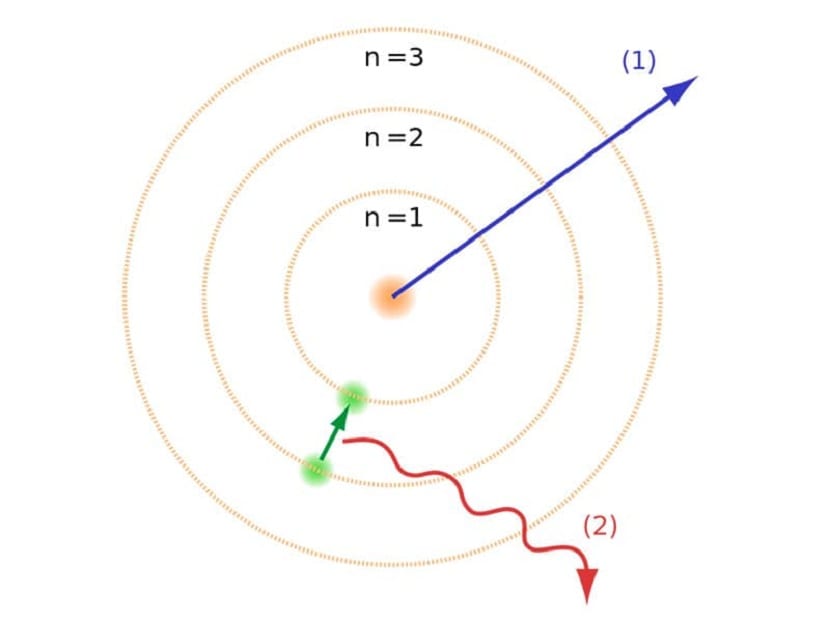
Te orbite koje smo spomenuli gdje se elektroni kreću nazvani su energetskim slojevima ili razinama energije. Odnosno, energija koju imaju elektroni nije uvijek ista, već je kvantizirana. Kvantne razine su različite orbite u kojima su atomi. Ovisno o tome u kojoj se orbiti nalazi u bilo kojem trenutku, imat će više ili manje energije. Orbite bliže jezgri atoma imaju veću količinu energije. S druge strane, što se više odmiču od jezgre, to je manje energije.
Model razine energije
Ovaj Bohrov atomski model, koji je implicirao da elektroni energiju mogu dobiti ili izgubiti samo skakanjem s jedne orbite na drugu, pomogao je riješiti kolaps koji je predložio Rutherfordov model. Prilikom prelaska s jedne razine energije na drugu, ona apsorbira ili emitira elektromagnetsko zračenje. Odnosno, kad skočite s napunjenije razine energije na manje napunjenu, oslobađate višak energije. Suprotno tome, kada pređe s niske razine energije na višu, apsorbira elektromagnetsko zračenje.
Kako je ovaj atomski model modifikacija Rutherfordovog modela, održavaju se karakteristike male središnje jezgre i s većinom mase atoma. Iako orbite elektrona nisu ravne poput onih na planetima, moglo bi se reći da se ti elektroni okreću oko svoje jezgre na sličan način kao planeti oko Sunca.
Bohrovi principi atomskog modela

Sada ćemo analizirati principe ovog atomskog modela. Riječ je o detaljnom objašnjenju navedenog modela i njegovog djelovanja.
- Čestice koje imaju pozitivan naboj Niske su koncentracije u usporedbi s ukupnim volumenom atoma.
- Elektroni s negativnim električnim nabojem su oni koji se nalaze okrećući se oko jezgre u kružnim orbitama energije.
- Postoje razine energije kroz orbite kojima elektroni cirkuliraju. Oni također imaju postavljenu veličinu, tako da između orbita nema posrednog stanja. Oni samo prelaze s jedne razine na drugu.
- Energija koju posjeduje svaka orbita povezana je s njezinom veličinom. Što je orbita dalje od jezgre atoma, to više energije ima.
- Razine energije imaju različit broj elektrona. Što je niža razina energije, to sadrži manje elektrona. Na primjer, ako smo na razini jedan, bit će do dva elektrona. Na razini 2 može biti do 8 elektrona, tako dalje.
- Kad se elektroni premjeste iz jedne orbite u drugu, oni apsorbiraju ili oslobađaju elektromagnetsku energiju. Ako prijeđete s jedne više razine energije na drugu manje, oslobađate preostalu energiju i obrnuto.
Ovaj je model bio revolucionaran i pokušao je dati stabilnost materijalu koji prethodni modeli nisu imali. Ovim atomskim modelom također su objašnjeni diskretni spektri emisije i apsorpcije plinova. To je prvi model koji je uveo koncept kvantiziranja ili kvantiziranja. Zbog toga se Bohrov atomski model može smatrati modelom na pola puta između klasične mehanike i kvantne mehanike. Iako također ima nedostataka, bio je prethodnik za kasniju kvantnu mehaniku Schrödingera i drugih znanstvenika.
Ograničenja i pogreške Bohrovog atomskog modela
Kao što smo spomenuli, ovaj model također ima određene nedostatke i pogreške. Prije svega, to ne objašnjava niti daje razloge zašto elektroni moraju biti ograničeni samo na određene orbite. Izravno pretpostavlja da elektroni imaju poznati radijus i orbitu. Međutim, to nije tako. Desetljeće kasnije Heisenbergov princip neizvjesnosti to je opovrgnuo.
Iako je ovaj atomski model uspio modelirati ponašanje elektrona u atomima vodika, nije bio toliko precizan kada su u pitanju elementi s većim brojem elektrona. To je model koji ima problema s objašnjenjem Zeemanovog učinka. Taj se učinak može vidjeti kada se spektralne crte podijele na dva ili više u prisutnosti vanjskog i statičkog magnetskog polja.
Još jedna od pogrešaka i ograničenja koja ovaj model ima jest ta da daje netočnu vrijednost kutnog gibanja orbite osnovnog stanja. Sve ove spomenute pogreške i ograničenja čine da je Bohrov atomski model godinama kasnije zamijenjen kvantnom teorijom.
Nadam se da ćete s ovim člankom saznati više o Bohrovom atomskom modelu i njegovim primjenama u znanosti.