
Nakon poznanstva Thomsonov atomski model, koji je smatrao da se elektroni nalaze u pozitivno nabijenom mediju, napredniji model poznat kao Rutherfordov atomski model. Znanstvenik zadužen za ovaj novi napredak u znanosti bio je Ernest Rutherford. Rođen je 20. kolovoza 1871., a umro 19. listopada 1937. Tijekom svog života dao je velik doprinos kemiji i svijetu znanosti općenito.
Stoga ćemo ovaj članak posvetiti kako bismo vam ispričali sve što trebate znati o Rutherfordovom atomskom modelu.
Eksperiment zlatnog lišća
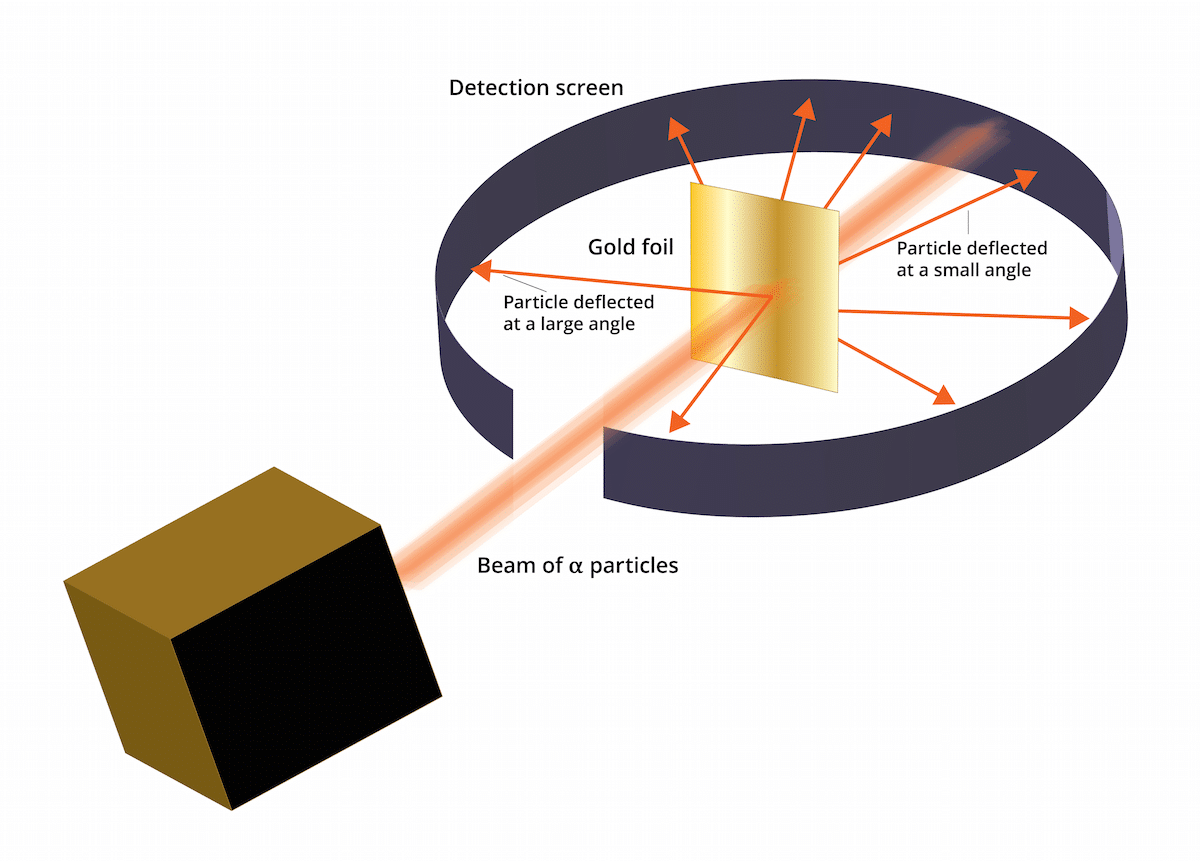
Stari thomson model rekao je da su se elektroni nalazili u pozitivno nabijenom mediju. 1909. Ernest Rutherford, u pratnji dvojice pomoćnika po imenu Geiger i Marsden, napravio je studiju poznatu kao pokus Zlatnog lišća gdje su mogli potvrditi da Thomsonov dobro poznati "puding od grožđica" bio je u krivu. A je li taj novi eksperiment uspio pokazati da je atom imao strukturu s jakim pozitivnim nabojem. Ovaj eksperiment ili bi mogao pomoći da se uspostave neki zaključci koji su na kraju predstavljeni kao Rutherfordov atomski model 1911. godine.
Pokus poznat kao List zlata nije jedinstven, ali provodili su se između 1909. i 1913. Za to su koristili laboratoriji za fiziku Sveučilišta u Manchesteru. Ti su eksperimenti bili od velike važnosti jer su se iz njihovih rezultata mogli utvrditi novi zaključci, što je dovelo do revolucionarnog atomskog modela.
Ovaj se pokus sastojao od sljedećeg: tanki lim zlata debeo samo 100 nm morao je biti bombardiran velikom količinom alfa čestica. Te su alfa čestice bile i ioni. Odnosno, atomi koji nemaju elektrone, pa su imali samo protone i neutrone. Imajući neutrone i protone, ukupni naboj atoma bio je pozitivan. Cilj ovog eksperimenta uglavnom je bio potvrditi je li Thomsonov model točan. Ako je ovaj model bio u pravu, alfa čestice morale su pravocrtno prolaziti kroz atome zlata.
Da bi se proučio otklon uzrokovan alfa česticama, oko fine zlatne folije morao se postaviti fluorescentni filtar cink sulfida. Rezultat ovog eksperimenta je da je uočeno da su neke čestice mogle pravocrtno proći kroz atome zlata u limu. Međutim, neke od ovih alfa čestica bile su skrenute u slučajnim smjerovima.
Zaključci pokusa Zlatni list

S obzirom na ovu činjenicu, nije bilo moguće potvrditi ono što se smatra prethodnim atomskim modelima. A to je da su ovi atomski modeli istaknuli da je pozitivni naboj jednoliko raspoređen u atomima i to bi ga olakšalo prijelaz jer njegov naboj u određenom trenutku ne bi bio tako jak.
Rezultati ovog eksperimenta sa zlatnim lišćem bili su potpuno neočekivani. Zbog toga je Rutherford pomislio da atom ima središte s jakim pozitivnim nabojem koji stvara alfa česticu pokušajte ga proslijediti odbačenim od strane središnje strukture. Kako bi se utvrdio pouzdaniji izvor, uzete su čestice u obzir u količinama onih koje su se reflektirale i onih koje nisu. Zahvaljujući ovom odabiru čestica bilo je moguće odrediti veličinu jezgre u usporedbi s putanjom elektrona koji se nalaze oko nje. Također bi se moglo zaključiti da je veći dio prostora atoma prazan.
Moglo se vidjeti, neke alfa čestice skrenule su zlatnom folijom. Neki od njih odstupali su samo pod vrlo malim kutovima. To je pomoglo zaključiti da pozitivni naboj na atomu nije ravnomjerno raspoređen. Odnosno, pozitivni naboj smješten je na atomu koncentrirano u vrlo malom volumenu prostora.
Vrlo malo alfa čestica se vratilo natrag. Ovo odstupanje ukazuje na sljedeće kako su se spomenute čestice mogle odskočiti. Zahvaljujući svim tim novim razmatranjima, Rutherfordov atomski model mogao bi se uspostaviti s novim idejama.
Rutherfordov atomski model

Proučit ćemo koja su načela Rutherfordovog atomskog modela:
- Čestice koje imaju pozitivan naboj unutar atoma raspoređeni su u vrlo malom volumenu ako ga usporedimo sa ukupnim volumenom spomenutog atoma.
- Gotovo sva masa koju ima atom nalazi se u tom spomenutom malom volumenu. Ta se unutarnja masa zvala jezgra.
- Elektroni koji imaju negativne naboje nalaze se rotirajući oko jezgre.
- Elektroni se okreću velikom brzinom kad su oko jezgre i to kružno. Te putanje nazivale su se orbite. Poslije ću poznate su kao orbitale.
- I oni elektroni koji su bili negativno nabijeni i jezgra samog pozitivno nabijenog atoma uvijek se drže zajedno zahvaljujući elektrostatičkoj privlačnoj sili.
Prihvaćanje i ograničenja Rutherfordovog atomskog modela
Očekivano, ovaj je novi model zamislio posve novu panoramu atoma u znanstvenom svijetu. Zahvaljujući ovom atomskom modelu, mnogi su kasniji znanstvenici mogli proučavati i odrediti broj elektrona koji ima svaki element u periodnom sustavu. Uz to, mogla bi se doći do novih otkrića koja pomažu na najjednostavniji način objasniti funkcioniranje atoma.
Međutim, ovaj model također ima određenih ograničenja i grešaka. Iako je to bio proboj u svijetu fizike, oni nisu bili ni savršeni ni cjeloviti model. I je li to od prema Newtonovim zakonima i važnom aspektu Maxwellovih zakona, ovaj model nije mogao objasniti određene stvari:
- Nije mogao objasniti kako su se negativni naboji mogli držati zajedno u jezgri. Prema elektroničkoj tibiji, pozitivni naboji moraju se odbiti.
- Još jedno proturječje bilo je prema temeljnim zakonima elektrodinamike. Ako bi se smatralo da se elektroni s pozitivnim nabojem okreću oko jezgre, trebali bi emitirati elektromagnetsko zračenje. Pri emitiranju ovog zračenja troši se energija da se elektroni sruše u jezgri. Stoga prugasti atomski model ne može objasniti stabilnost atoma.
Nadam se da ćete s ovim podacima saznati više o Rutherfordovom atomskom modelu.