
क्या आपने कभी देखा है बोहर परमाणु मॉडल। यह एक महत्वपूर्ण खोज है जो इस वैज्ञानिक ने विज्ञान के लिए बनाई है, विशेष रूप से विद्युत चुंबकत्व और इलेक्ट्रोकैमिस्ट्री। पहले रदरफोर्ड मॉडल था, जो काफी क्रांतिकारी और बहुत सफल था, लेकिन अन्य परमाणु कानूनों जैसे मैक्सवेल और न्यूटन के साथ कुछ संघर्ष थे।
इस लेख में हम आपको बोहर के परमाणु मॉडल के बारे में जानने के लिए आपको सब कुछ बताने जा रहे हैं, साथ ही इस विषय पर किसी भी संदेह को स्पष्ट करने के लिए इसके विवरण।
समस्याओं को हल करने में मदद की
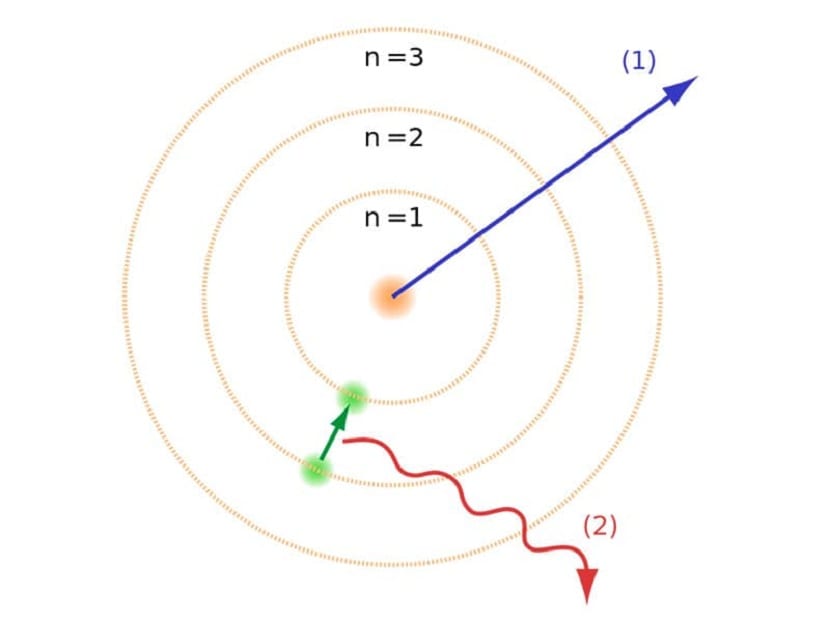
जैसा कि हमने लेख की शुरुआत में उल्लेख किया है, इस परमाणु मॉडल ने कुछ परमाणु संघर्षों के साथ मौजूद कुछ संघर्षों को हल करने में मदद की। पिछले रदरफोर्ड मॉडल में, हमें करना था एक नकारात्मक विद्युत आवेश के साथ बढ़ने वाले इलेक्ट्रॉनों को एक प्रकार के विद्युत चुम्बकीय विकिरण का उत्सर्जन करना पड़ता था। यह वहाँ से बाहर विद्युत चुंबकत्व के कानूनों के कारण पूरा होना चाहिए। ऊर्जा के इस नुकसान के कारण इलेक्ट्रॉनों को केंद्र की ओर सर्पिल करके उनकी कक्षा में कम किया जा सकता है। जब वे केंद्र पर पहुँचे तो वे ढह गए, कोर से टकरा गए।
इससे सिद्धांत में एक समस्या उत्पन्न हुई क्योंकि यह परमाणुओं के नाभिक के साथ नहीं गिर सकता था, लेकिन इलेक्ट्रॉनों के प्रक्षेपवक्र को अलग होना चाहिए था। इसे बोहर परमाणु मॉडल के साथ हल किया गया था। यह बताते हैं कि इलेक्ट्रॉनों को कुछ कक्षाओं में नाभिक के चारों ओर परिक्रमा की अनुमति होती है और जिनकी एक विशिष्ट ऊर्जा होती है। ऊर्जा प्लैंक स्थिर के लिए आनुपातिक है।
ये कक्षाएँ जिनका हमने उल्लेख किया है कि जहाँ इलेक्ट्रॉन चलते हैं, उन्हें ऊर्जा स्तर या ऊर्जा स्तर कहा जाता है। यही है, इलेक्ट्रॉनों के पास ऊर्जा हमेशा समान नहीं होती है, लेकिन इसकी मात्रा निर्धारित होती है। क्वांटम का स्तर विभिन्न कक्षाएँ हैं जिनमें परमाणु होते हैं। किसी भी समय यह किस कक्षा में है, इसके आधार पर, इसमें कम या ज्यादा ऊर्जा होगी। परमाणु के नाभिक के करीब कक्षा में ऊर्जा की एक बड़ी मात्रा होती है। दूसरी तरफ, नाभिक से कम ऊर्जा से आगे।
ऊर्जा स्तर का मॉडल
यह बोहर परमाणु मॉडल, जिसका अर्थ था कि इलेक्ट्रॉन केवल एक कक्षा से दूसरी कक्षा में कूदकर ऊर्जा प्राप्त कर सकते हैं या खो सकते हैं, ने रदरफोर्ड के मॉडल द्वारा प्रस्तावित पतन को हल करने में मदद की। एक ऊर्जा स्तर से दूसरे में जाने पर, यह विद्युत चुम्बकीय विकिरण को अवशोषित या उत्सर्जित करता है। यही है, जब आप अधिक आवेशित ऊर्जा स्तर से कम आवेश वाले छलांग लगाते हैं, तो आप अतिरिक्त ऊर्जा छोड़ते हैं। इसके विपरीत, जब यह एक निम्न ऊर्जा स्तर से एक उच्च तक जाता है, तो यह विद्युत चुम्बकीय विकिरण को अवशोषित करता है।
जैसा कि यह परमाणु मॉडल रदरफोर्ड मॉडल का एक संशोधन है, छोटे केंद्रीय नाभिक की विशेषताओं और परमाणु के अधिकांश द्रव्यमान के साथ बनाए रखा जाता है। हालाँकि, इलेक्ट्रॉनों की कक्षाएँ समतल नहीं होती हैं, जो कि ग्रहों की तरह होती हैं, यह कहा जा सकता है कि ये इलेक्ट्रॉन अपने नाभिक के चारों ओर इसी तरह घूमते हैं जैसे ग्रह सूर्य के चारों ओर करते हैं।
बोहर के परमाणु मॉडल सिद्धांत

अब हम इस परमाणु मॉडल के सिद्धांतों का विश्लेषण करने जा रहे हैं। यह उक्त मॉडल और इसके संचालन की विस्तृत व्याख्या के बारे में है।
- कण जो एक सकारात्मक चार्ज है वे परमाणु की कुल मात्रा की तुलना में कम एकाग्रता में हैं।
- एक नकारात्मक विद्युत आवेश वाले इलेक्ट्रॉन वे होते हैं जो ऊर्जा के वृत्ताकार कक्षाओं में नाभिक के चारों ओर घूमते हुए पाए जाते हैं।
- कक्षाओं के ऊर्जा स्तर हैं जिनके माध्यम से इलेक्ट्रॉनों का प्रसार होता है। उनके पास एक सेट आकार भी है, इसलिए कक्षाओं के बीच कोई मध्यवर्ती स्थिति नहीं है। वे सिर्फ एक स्तर से दूसरे स्तर पर जाते हैं।
- प्रत्येक कक्षा के पास जो ऊर्जा होती है वह उसके आकार से संबंधित होती है। आगे की कक्षा परमाणु के नाभिक से होती है, जितनी अधिक ऊर्जा होती है।
- ऊर्जा के स्तर में इलेक्ट्रॉनों की अलग-अलग संख्या होती है। ऊर्जा स्तर जितना कम होगा, उसमें कम इलेक्ट्रॉन होंगे। उदाहरण के लिए, यदि हम एक स्तर पर हैं, तो दो इलेक्ट्रॉनों तक होंगे। स्तर 2 पर, 8 इलेक्ट्रॉन तक हो सकते हैं, इत्यादि।
- जब इलेक्ट्रॉन एक कक्षा से दूसरी कक्षा में जाते हैं, तो वे विद्युत चुंबकीय ऊर्जा को अवशोषित करते हैं या छोड़ते हैं। यदि आप एक और ऊर्जा स्तर से दूसरे कम में जाते हैं, तो आप ऊर्जा छोड़ते हैं और इसके विपरीत।
यह मॉडल क्रांतिकारी था और उस सामग्री को स्थिरता देने की कोशिश की जो पिछले मॉडल के पास नहीं थी। इस परमाणु मॉडल के साथ गैसों के असतत उत्सर्जन और अवशोषण स्पेक्ट्रा को भी समझाया गया था। यह पहला मॉडल था जिसने परिमाणीकरण या परिमाणीकरण की अवधारणा पेश की। यह बोहर के परमाणु मॉडल को एक मॉडल बनाता है जो शास्त्रीय यांत्रिकी और क्वांटम यांत्रिकी के बीच आधा है। हालांकि इसमें भी कमियां हैं, यह श्रोडिंगर और अन्य वैज्ञानिकों के बाद के क्वांटम यांत्रिकी के लिए एक अग्रदूत मॉडल था।
बोहर परमाणु मॉडल की सीमाएं और त्रुटियां
जैसा कि हमने उल्लेख किया है, इस मॉडल में कुछ कमियां और त्रुटियां भी हैं। सबसे पहले, यह व्याख्या नहीं करता है या कारण बताता है कि इलेक्ट्रॉनों को केवल विशिष्ट कक्षाओं तक सीमित क्यों किया जाना चाहिए। यह सीधे मानता है कि इलेक्ट्रॉनों में एक ज्ञात त्रिज्या और कक्षा है। हालाँकि, ऐसा नहीं है। एक दशक बाद हाइजेनबर्ग के अनिश्चितता के सिद्धांत ने इसे खारिज कर दिया।
यद्यपि यह परमाणु मॉडल हाइड्रोजन परमाणुओं में इलेक्ट्रॉनों के व्यवहार को मॉडल करने में सक्षम था, लेकिन जब यह इलेक्ट्रॉनों की अधिक संख्या के साथ तत्वों की बात आती है तो यह इतना सटीक नहीं था। यह एक मॉडल है Zeeman प्रभाव को समझाने में परेशानी होती है। यह प्रभाव तब देखा जा सकता है जब बाहरी और स्थैतिक चुंबकीय क्षेत्र की उपस्थिति में वर्णक्रमीय रेखाओं को दो या अधिक में विभाजित किया जाता है।
इस मॉडल की त्रुटियों और सीमाओं में से एक यह है कि यह जमीन की कक्षा की कोणीय गति के लिए एक गलत मूल्य प्रदान करता है। इन सभी त्रुटियों और सीमाओं का उल्लेख है कि बोह्र के परमाणु मॉडल को क्वांटम सिद्धांत द्वारा वर्षों बाद बदल दिया गया था।
मुझे उम्मीद है कि इस लेख से आप बोहर के परमाणु मॉडल और विज्ञान में इसके अनुप्रयोगों के बारे में अधिक जान सकते हैं।