
રાસાયણિક પરિવર્તન એ પદાર્થનું પરિવર્તન છે જે તેના રાસાયણિક બંધારણને બદલે છે, એટલે કે, તે તેના ગુણધર્મોને બદલે છે, માત્ર તેના આકારને જ નહીં. આનો અર્થ એ છે કે રાસાયણિક પરિવર્તન, જેને રાસાયણિક પ્રતિક્રિયા અથવા રાસાયણિક ઘટના તરીકે પણ ઓળખવામાં આવે છે, તેમાં એક પદાર્થ અથવા સંયોજનમાં રાસાયણિક બોન્ડને તોડીને નવા પદાર્થ અથવા સંયોજનની રચનાનો સમાવેશ થાય છે. અસંખ્ય છે રાસાયણિક ફેરફારો વિશ્વમાં
આ કારણોસર, અમે આ લેખ તમને જણાવવા માટે સમર્પિત કરવા જઈ રહ્યા છીએ કે અસ્તિત્વમાં રહેલા મુખ્ય રાસાયણિક ફેરફારો શું છે અને તેનું ઉદાહરણ છે.
રાસાયણિક ફેરફારો શું છે?

જ્યારે બે અથવા વધુ પદાર્થો (જેને રિએક્ટન્ટ્સ અથવા રિએક્ટન્ટ્સ કહેવાય છે) રાસાયણિક પ્રતિક્રિયામાંથી પસાર થાય છે, પ્રક્રિયામાં તેમની રાસાયણિક રચનામાં ફેરફાર થાય છે અને વપરાશ કરવામાં સક્ષમ હોય છે (એન્ડોથર્મિક પ્રતિક્રિયાઓ) અથવા મુક્તિ (એક્ઝોથર્મિક પ્રતિક્રિયાઓ) ઊર્જા, બે અથવા વધુ પદાર્થોનું ઉત્પાદન કરે છે (જેને ઉત્પાદન કહેવાય છે). કેટલીક રાસાયણિક પ્રતિક્રિયાઓ મનુષ્યો માટે ખતરનાક હોય છે કારણ કે તેમાં ઝેરી અથવા ક્ષતિગ્રસ્ત સંયોજનો સામેલ થઈ શકે છે અથવા ઉત્પન્ન થઈ શકે છે. અન્ય પ્રતિક્રિયાઓ, જેમ કે ચોક્કસ એક્સોથેર્મિક પ્રતિક્રિયાઓ, વિસ્ફોટનું કારણ બની શકે છે.
રાસાયણિક ઉદ્યોગમાં, ઘણી સામગ્રી કે જેનો આપણે આપણા રોજિંદા જીવનમાં ઉપયોગ કરીએ છીએ તે નિયંત્રિત રાસાયણિક પ્રતિક્રિયાઓ દ્વારા ઉત્પન્ન થાય છે. કેટલીક પ્રતિક્રિયાઓ સ્વયંભૂ થાય છે, અન્ય માનવીઓ દ્વારા ફેક્ટરીઓ અથવા રાસાયણિક પ્રયોગશાળાઓમાં ઉત્પન્ન થાય છે. રાસાયણિક પ્રતિક્રિયા થવામાં ચોક્કસ સમય લાગે છે. રિએક્ટન્ટ્સની પ્રકૃતિ અને જે પરિસ્થિતિઓમાં પ્રતિક્રિયા થાય છે તેના આધારે.
તેથી, રાસાયણિક પ્રતિક્રિયાઓના દરને અસર કરતા પરિબળોમાં સામાન્ય રીતે સમાવેશ થાય છે:
- તાપમાન વધે છે. તાપમાનમાં વધારો રાસાયણિક પ્રતિક્રિયાના દરમાં વધારો કરે છે.
- વધારો દબાણ. દબાણમાં વધારો સામાન્ય રીતે રાસાયણિક પ્રતિક્રિયાના દરમાં વધારો કરે છે. આ સામાન્ય રીતે ત્યારે થાય છે જ્યારે દબાણમાં ફેરફાર માટે સંવેદનશીલ પદાર્થો, જેમ કે વાયુઓ, પ્રતિક્રિયા આપે છે. પ્રવાહી અને ઘન પદાર્થોના કિસ્સામાં, દબાણના ફેરફારો તેમના પ્રતિક્રિયા દરમાં નોંધપાત્ર ફેરફારોનું કારણ નથી.
- રીએજન્ટ એકત્રીકરણ સ્થિતિ. ઘન સામાન્ય રીતે પ્રવાહી અથવા વાયુઓ કરતાં વધુ ધીમેથી પ્રતિક્રિયા આપે છે, જો કે ઝડપ પણ દરેક પદાર્થની પ્રતિક્રિયા પર આધાર રાખે છે.
- ઉત્પ્રેરકનો ઉપયોગ. તે એવા પદાર્થો છે જેનો ઉપયોગ રાસાયણિક પ્રતિક્રિયાઓની ગતિ વધારવા માટે થાય છે. આ પદાર્થો પ્રતિક્રિયામાં દખલ કરતા નથી, તેઓ માત્ર પ્રતિક્રિયા થાય છે તે દરને નિયંત્રિત કરે છે. અવરોધકો તરીકે ઓળખાતા પદાર્થો પણ છે, જેનો ઉપયોગ એ જ રીતે થાય છે પરંતુ તેની વિપરીત અસર હોય છે, જે પ્રતિક્રિયાને ધીમું કરે છે.
- પ્રકાશ ઊર્જા. જ્યારે પ્રકાશ તેમના પર પડે છે ત્યારે કેટલીક રાસાયણિક પ્રતિક્રિયાઓ ઝડપી બને છે.
- રીએજન્ટ એકાગ્રતા. મોટાભાગની રાસાયણિક પ્રતિક્રિયાઓ ઝડપથી થાય છે જો રિએક્ટન્ટ્સની સાંદ્રતા વધારે હોય.
રાસાયણિક ફેરફારોના ઉદાહરણો
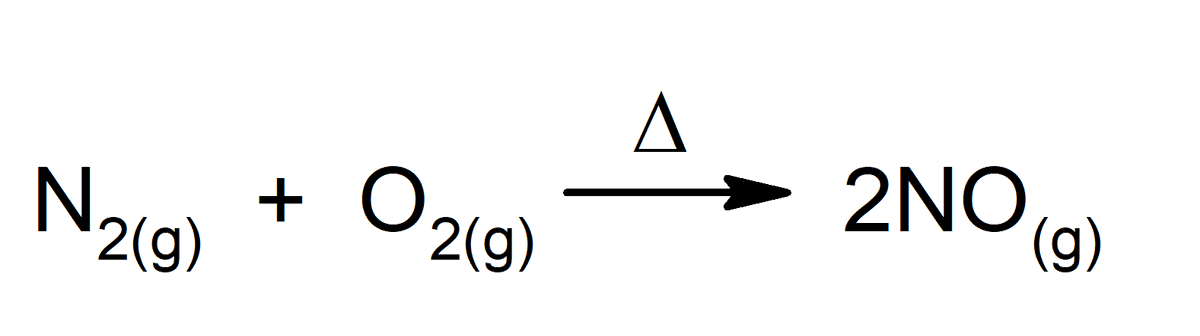
કોઈપણ રાસાયણિક પ્રતિક્રિયા એ રાસાયણિક પરિવર્તનનું સંપૂર્ણ ઉદાહરણ છે, તે પણ જે આપણા શરીરની અંદર થાય છે. કેટલાક ઉદાહરણો છે:
- શ્વાસ. આ એક રાસાયણિક રીતે બદલાયેલી જૈવિક પ્રક્રિયા છે જેમાં હવામાંથી ઓક્સિજન લેવામાં આવે છે અને તેનો ઉપયોગ ખોરાકમાંથી આપણને મળતા ગ્લુકોઝ સાથે પ્રતિક્રિયા કરવા માટે થાય છે, જે ઉચ્ચ સ્તરની રાસાયણિક ઊર્જા (ATP) અને મોટા પ્રમાણમાં કચરો કાર્બન ડાયોક્સાઇડ (CO2) ઉત્પન્ન કરે છે. ઉત્સર્જન.
- એસિડ વરસાદ. તે ગંભીર વાયુ પ્રદૂષણવાળા વાતાવરણમાં થાય છે. તે સામાન્ય રીતે વાદળોમાં સંગ્રહિત પાણી અને હવામાં વિખરાયેલા અન્ય વાયુઓ વચ્ચેના રાસાયણિક પરિવર્તનનું પરિણામ છે, જેનું સલ્ફર ઓક્સાઇડ અથવા નાઇટ્રોજન ઓક્સાઇડનું પ્રમાણ સલ્ફ્યુરિક એસિડ અથવા નાઈટ્રિક એસિડ બનાવે છે જે વરસાદના પાણી સાથે પડે છે અને મીઠું બનાવે છે. બેટરીની અંદર જે પ્રતિક્રિયા થાય છે તે એસિડ અને મેટલ વચ્ચે થાય છે. ઉદાહરણ તરીકે, લેડ અને સલ્ફ્યુરિક એસિડનો ઉપયોગ કરતી બેટરી લીડ(II) સલ્ફેટ, સફેદ મીઠું ઉત્પન્ન કરે છે. ઓઝોન વિઘટન. ઓઝોન પરમાણુઓ અમુક પ્રકારના પ્રકાશની ક્રિયા હેઠળ ઓક્સિજન પરમાણુઓમાં તૂટી જાય છે.
રાસાયણિક પરિવર્તન અને ભૌતિક પરિવર્તન

પદાર્થમાં ભૌતિક ફેરફારો તેની રચનામાં ફેરફાર કરતા નથી, એટલે કે, તે પદાર્થની રાસાયણિક રચનામાં ફેરફાર કરતા નથી, તેથી ભૌતિક ફેરફારો દ્વારા પદાર્થોને તોડી શકાતા નથી અથવા રચના કરી શકતા નથી. ભૌતિક પરિવર્તન ફક્ત પદાર્થના ભૌતિક ગુણધર્મોને બદલે છે, જેમ કે આકાર, ઘનતા અને એકત્રીકરણની સ્થિતિ (ઘન, પ્રવાહી, વાયુ). બીજી બાજુ શારીરિક ફેરફારો, તેઓ સામાન્ય રીતે ઉલટાવી શકાય તેવું હોય છે કારણ કે તેઓ પદાર્થના આકાર અથવા સ્થિતિને બદલે છે, પરંતુ તેની રચનાને બદલે છે.
ઉદાહરણ તરીકે, જ્યારે પાણી ઉકળે છે, ત્યારે આપણે પ્રવાહીને ગેસમાં ફેરવી શકીએ છીએ, પરંતુ પરિણામી વરાળ હજુ પણ પાણીના અણુઓથી બનેલી છે. તેનાથી વિપરિત, જો આપણે પાણીને સ્થિર કરીએ, તો તે ઘન બને છે, પરંતુ હજુ પણ રાસાયણિક રીતે તે જ પદાર્થ છે.
બીજું એક ઉદાહરણ છે લિક્વિફાઇડ ગેસનો ઉપયોગ અમે અમારા સિગારેટ લાઇટરમાં કરીએ છીએ, સામાન્ય રીતે બ્યુટેન (C4H10) અથવા પ્રોપેન (C3H8) જે ઉચ્ચ દબાણ લાગુ થવા પર પ્રવાહી બની જાય છે, પરંતુ તેની રાસાયણિક રચનામાં ફેરફાર થતો નથી.
રાસાયણિક પરિવર્તન પદાર્થમાં અણુઓની ગોઠવણ અને બંધનને બદલી નાખે છે જેથી તેઓ અલગ રીતે જોડાય, પરિણામે મૂળ કરતાં અલગ પદાર્થ બને છે. જ્યારે રાસાયણિક પરિવર્તન થાય છે, ત્યારે તમે હંમેશા તે જ પ્રમાણમાં પદાર્થ સાથે સમાપ્ત કરો છો જેની સાથે તમે શરૂઆત કરી હતી, પછી ભલે તે અલગ ગુણોત્તરમાં હોય, કારણ કે પદાર્થનું સર્જન અથવા નાશ કરી શકાતું નથી, ફક્ત રૂપાંતરિત થાય છે.
ઉદાહરણ તરીકે, જો આપણે પાણી (H2O) અને પોટેશિયમ (K) પર પ્રતિક્રિયા કરીએ, તો આપણે બે નવા પદાર્થો મેળવીશું: પોટેશિયમ હાઇડ્રોક્સાઇડ (KOH) અને હાઇડ્રોજન ગેસ (H2). આ એક પ્રતિક્રિયા છે જે સામાન્ય રીતે ઘણી બધી ઊર્જા છોડે છે અને તેથી તે ખૂબ જ જોખમી છે.
પદાર્થમાં રાસાયણિક ફેરફારોના ઉદાહરણો
બેકિંગ કૂકીઝ અથવા કેક
સામાન્ય વસ્તુઓ જેમ કે કૂકીઝ, કેક, કપકેક વગેરે. આથો તરીકે ઓળખાતી રાસાયણિક પ્રતિક્રિયા છુપાવો, જેમાં આથો દ્વારા ઉત્પાદિત વાયુઓને કારણે કણક વધે છે. બ્રેડ બનાવવામાં, ખમીર સ્ટાર્ચને ગ્લુકોઝમાં રૂપાંતરિત કરે છે.
પાચન
ખોરાકનું પાચન એ હાઇડ્રોલિસિસ (પાણીની ક્રિયા દ્વારા કાર્બનિક પદાર્થોનું વિભાજન) દ્વારા પદાર્થના રાસાયણિક પરિવર્તનનું સ્પષ્ટ ઉદાહરણ છે. ફળો, શાકભાજી, માંસ વગેરેના રૂપમાં આપણે જે ખોરાક ખાઈએ છીએ, તેઓ પોષક તત્વોને વધુ સારી રીતે શોષવા માટે ગેસ્ટ્રિક જ્યુસ સાથે મિશ્રણ કરવાની પ્રક્રિયામાંથી પસાર થાય છે અને જીવતંત્રની જરૂરિયાતો અનુસાર તેમને વિવિધ પદાર્થોમાં રૂપાંતરિત કરો.
આ જ પ્રક્રિયામાં, વધારાના તત્વો અથવા ઝેરને જીવતંત્રમાંથી મૂળ કરતાં અલગ રીતે દૂર કરવામાં આવે છે; મળ, પેશાબ, પરસેવો વગેરેના રૂપમાં.
પલક
આથો એક કેટાબોલિક પ્રક્રિયા છે જેમાં ઓક્સિજનની અછતને કારણે ગ્લુકોઝના પરમાણુઓ તૂટી જાય છે. આથોની પ્રક્રિયા દ્વારા મેળવવામાં આવતા કેટલાક આલ્કોહોલિક પીણાઓમાં સાઇડર, બીયર અને સોફ્ટ વાઇન છે, જે બાદમાં વિશ્વમાં સૌથી ઓછા જાણીતા પીણાંઓમાંનું એક છે. રામબાણ છોડમાંથી કારીગર પ્રક્રિયા દ્વારા પુલ્ક મેળવવામાં આવે છેl, જેમાં પદાર્થની પરિપક્વતા એ અંતિમ ઉત્પાદન મેળવવા માટે ચાવીરૂપ છે, જે સફેદ, ખાટા અને ચીકણા છે, ખૂબ ચોક્કસ સ્વાદ સાથે જે કોઈપણ તાળવાને અનુકૂળ નથી.
બ્રેડ, દહીં અને ચીઝ બનાવતી વખતે પણ આથો આવે છે.
કેન્ડી
કારામેલ એ પદાર્થમાં રાસાયણિક પરિવર્તનનું મૂળભૂત ઉદાહરણ છે, કારણ કે ઘન સફેદ ખાંડ, થોડી મિનિટો માટે ગરમ થાય છે, તે સુખદ સુગંધ સાથે એમ્બર-રંગીન ગોમાં ફેરવાય છે. બીજા શબ્દોમાં કહીએ તો, મૂળથી સંપૂર્ણપણે અલગ ઉત્પાદન જનરેટ થાય છે.
હું આશા રાખું છું કે આ માહિતીથી તમે રાસાયણિક ફેરફારો અને તેમના ઉદાહરણો વિશે વધુ જાણી શકશો.