
La La loi de Boyle il a été découvert par Robert Boyle au XNUMXème siècle et a jeté les bases pour expliquer la relation entre la pression et le volume présents dans les gaz. Grâce à une série d'expériences, il a réussi à montrer que si la température est constante, un gaz réduit son volume lorsqu'il est soumis à plus de pression, et augmente de volume si la pression est réduite.
Dans cet article, nous allons vous dire tout ce que vous devez savoir sur la loi de Boyle, ses caractéristiques et son importance.
Caractéristiques principales
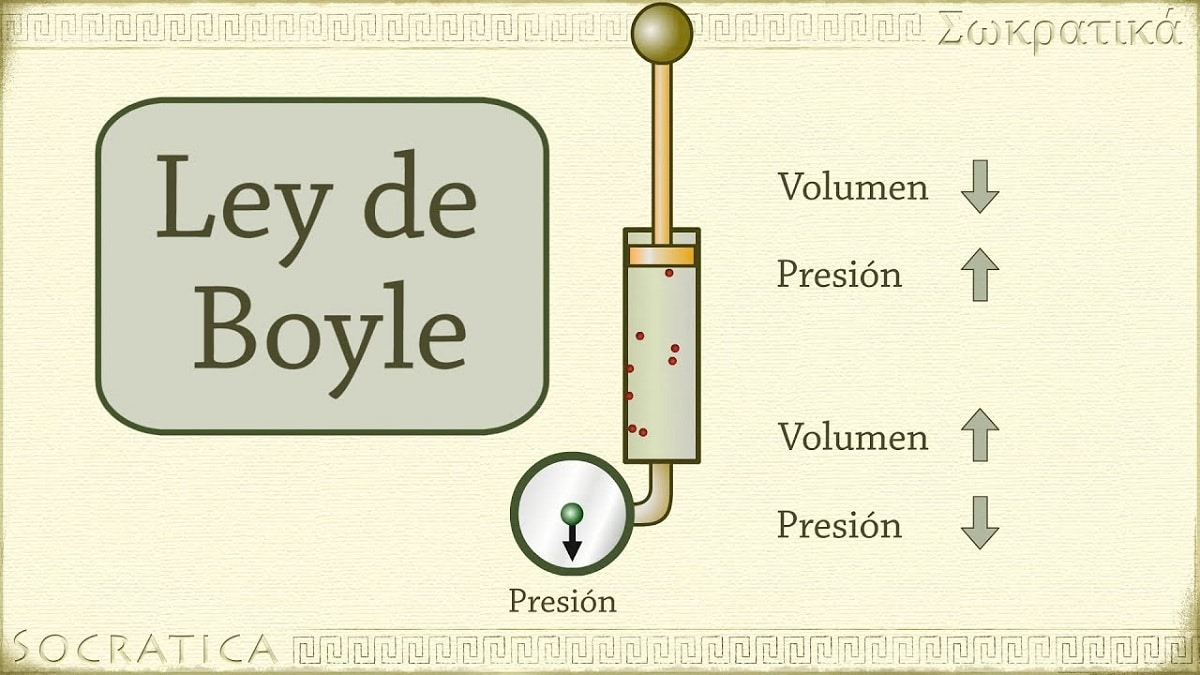
En 1662, Robert Boyle découvre que la pression exercée sur un gaz est inversement proportionnelle à son volume et à son nombre de moles à température constante. En d'autres termes, si la pression appliquée à un gaz est doublée, le même gaz sera comprimé et son volume sera divisé par deux.
À mesure que le volume du récipient contenant le gaz augmente, la distance que les particules doivent parcourir avant d'entrer en collision avec les parois du récipient augmente également. Cette augmentation de distance permet à la fréquence des chocs de diminuer, donc la pression sur la paroi est moindre qu'avant lorsque le volume était plus petit.
La loi de Boyle a été découverte pour la première fois en 1662 par Robert Boyle. Edme Mariotte était un autre scientifique qui a pensé et est arrivé aux mêmes conclusions que Boyle, cependant, Mariotte ne rendit ses travaux publics qu'en 1676. C'est pourquoi dans de nombreux ouvrages on retrouve cette loi appelée Loi de Boyle et Mariot Loi de Boyle-Mariot, également connue sous le nom de Loi de Mattut, développée par le physicien et chimiste britannique Robert Elle a été formulée indépendamment par Boyle et le physicien et botaniste français Edmé Mattout.
Il fait référence à l'une des lois qui relient le volume et la pression d'un gaz à une certaine quantité de gaz maintenue à une température constante. La loi de Boyle énonce ce qui suit : La pression exercée par une force est physiquement inversement proportionnelle au volume de matière gazeuse tant que sa température reste constante. Ou plus simplement, on peut l'interpréter comme : à température constante plus élevée, le volume d'une masse fixe de gaz est inversement proportionnel à la pression constante qu'elle exerce.
Expériences et applications de la loi de Boyle

Pour prouver la théorie de la loi de Boyle, Mariot était chargé d'introduire du gaz dans un cylindre à piston et a pu vérifier les différentes pressions créées lors de la descente du piston. On déduit de cette expérience que lorsque le volume augmente, la pression diminue.
La loi de Boyle a de nombreuses applications dans la vie moderne, parmi lesquelles on peut citer par exemple la plongée, c'est parce que le plongeur doit expulser l'air de ses poumons lors de la remontée car il se dilate lorsque la pression diminue, sinon cela peut endommager les tissus.
On le trouve dans tous les équipements qui utilisent ou sont alimentés par une puissance pneumatique, tels que les bras robotiques qui utilisent des composants tels que des pistons pneumatiques, des actionneurs, des régulateurs de pression et des soupapes de surpression.
Les moteurs à essence, à gaz ou diesel utilisent également la loi de Boyle lors de la combustion interne, car la première fois que l'air pénètre dans le cylindre avec le volume et la pression, la deuxième fois, il réduit le volume en augmentant la pression.
Les voitures ont des systèmes d'airbag qui fonctionnent en expulsant une certaine quantité d'air ou de gaz d'une chambre qui atteint l'airbag extérieur, où la pression diminue et le volume augmente en maintenant une température constante.
La loi de Boyle est très importante aujourd'hui car c'est la loi qui nous parle et explique le comportement des gaz. Cela explique définitivement que la pression et le volume d'un gaz sont inversement proportionnels l'un à l'autre. Ainsi, lorsqu'une pression est appliquée à un gaz, son volume diminue et sa pression augmente.
modèle de gaz parfait

La loi de Boyle-Mariotte s'applique aux gaz dits parfaits, un modèle théorique qui simplifie grandement le comportement de tout gaz, en supposant :
- molécules de gaz ils sont si petits qu'il n'est pas nécessaire de penser à leur taille, d'autant plus que c'est beaucoup plus petit que la distance qu'ils parcourent.
- En outre, les molécules interagissent à peine, sauf lorsqu'ils entrent en collision très brièvement, et lorsqu'ils le font, la collision est élastique, de sorte que la quantité de mouvement et l'énergie cinétique sont conservées.
- Supposons enfin que cette énergie cinétique soit proportionnelle à la température de l'échantillon gazeux, c'est-à-dire plus les particules sont agitées, plus la température est élevée.
Les gaz légers, quelle que soit leur identité, suivent très strictement ces consignes dans des conditions standards de température et de pression (soit : 0°C et pression atmosphérique (1 atmosphère). Pour ces gaz, la loi de Boyle-Mariotte décrit très précisément leur comportement. .
Puisque P∙V est constant à une température donnée, si la pression du gaz change, le volume change de sorte que le produit reste le même, donc dans deux états différents 1 et 2, l'égalité peut s'exprimer comme suit :
P1∙V1 = P2∙V2
Puis connaissant un état, plus une variable de l'autre état, vous pouvez connaître la variable manquante en la supprimant de la loi de Boyle-Mariot.
Histoire de la loi de Boyle
Chimiste britannique. Pionnier des expériences dans le domaine de la chimie, notamment dans les propriétés des gaz,
La thèse de Robert Boyle sur le comportement de la matière au niveau des particules a été un précurseur de la théorie moderne des éléments chimiques. Il a également été membre fondateur de la Royal Society of London.
Robert Boyle est né dans une famille noble en Irlande et a fréquenté les meilleures écoles anglaises et européennes. De 1656 à 1668, il a été l'assistant de Robert Hooke à l'Université d'Oxford, collaborant avec lui sur une série d'expériences qui ont déterminé les propriétés physiques de l'air et comment il brûle, respire et transmet le son.
Les résultats de ces contributions ont été recueillis dans leur "Nouvelles expériences physico-mécaniques sur l'élasticité de l'air et ses effets» (1660). Dans la seconde édition de cet ouvrage (1662), il révèle la célèbre propriété des gaz, la loi de Boyle-Mariotte, qui énonce que le volume occupé par un gaz à température constante est inversement proportionnel à sa pression. Aujourd'hui, on sait que cette loi n'est satisfaite que lorsque le comportement idéal théorique des gaz est accepté.
J'espère qu'avec ces informations, vous pourrez en apprendre davantage sur la loi de Boyle, ses caractéristiques et ses applications dans le monde de la science.