
L'eau est la ressource la plus précieuse de l'être humain et de tous les êtres vivants de la planète. Cette ressource est un élément susceptible de se trouver naturellement dans différents états. Les états de l'eau Ils sont très importants dans le cycle hydrologique pour établir un flux continu universel.
Pour cette raison, nous allons consacrer cet article à vous dire quels sont les principaux états de l'eau, quelles sont leurs caractéristiques et l'importance de chacun d'entre eux.
états de l'eau
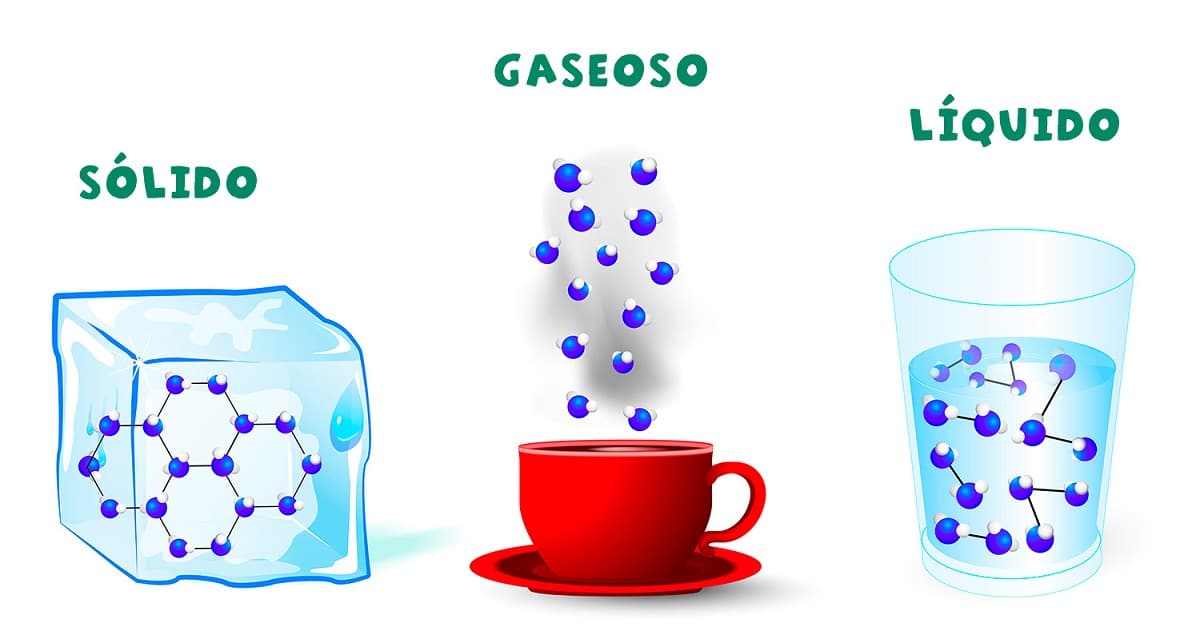
Nous savons tous ce qu'est l'eau et nous connaissons ses trois formes, appelées ses états physiques : liquide (eau), solide (glace) et gazeux (vapeur). Ce sont les trois formes sous lesquelles l'eau peut être trouvée dans la nature sans changer du tout sa composition chimique : H2O (hydrogène et oxygène).
L'état de l'eau dépend de la pression qui l'entoure et de la température à laquelle elle est exposée, c'est-à-dire des conditions environnementales. Par conséquent, en manipulant ces conditions, l'eau liquide peut être convertie en un état solide ou gazeux et vice versa.
Compte tenu de l'importance de l'eau pour la vie et de son abondance sur Terre, votre état physique est utilisé comme référence dans de nombreux systèmes de mesure et peut donc être comparé à d'autres matériaux et substances.
propriétés de l'eau

En raison de la tension superficielle, les insectes et les araignées peuvent se déplacer dans l'eau. L'eau est une substance inodore, incolore et insipide avec un pH neutre (7, ni acide ni alcalin). Il est composé de deux atomes d'hydrogène et d'un atome d'oxygène dans chaque molécule.
Ses particules ont d'énormes forces de cohésion qui les maintiennent ensemble, il a donc une tension superficielle importante (que certains insectes utilisent pour "marcher" sur l'eau) et nécessite beaucoup d'énergie pour changer son état physique.
L'eau est connue comme le "solvant universel" car il peut dissoudre plus de substances que tout autre liquide. De plus, c'est un composé essentiel de la vie et il est présent en grande quantité dans tous les organismes vivants. L'eau couvre les deux tiers de la superficie totale de notre planète.
Les différents états de l'eau et leurs caractéristiques
Liquide
A l'état liquide, l'eau est fluide et flexible. L'état auquel nous sommes le plus associés est le liquide, qui est l'état le plus dense et le plus incompréhensible, et le plus abondant sur notre planète. A l'état liquide, les particules d'eau sont proches les unes des autres, mais pas trop proches les unes des autres. Ainsi, l'eau liquide a la souplesse et la fluidité des liquides, mais perd sa forme pour prendre la forme du récipient qui la contient.
Par conséquent, l'eau liquide nécessite certaines conditions d'énergie (chaleur, température) et de pression. L'eau est un liquide à des températures comprises entre 0 et 100º C et à la pression atmosphérique normale. Cependant, s'il est soumis à des pressions plus élevées (eau surchauffée), il peut dépasser son point d'ébullition et à l'état liquide atteindre une température critique de 374°C, température la plus élevée à laquelle un gaz peut se liquéfier. L'eau liquide se trouve couramment dans les océans, les lacs, les rivières et les sédiments souterrains, mais elle se trouve également à l'intérieur des organismes vivants.
État solide
L'état solide de l'eau, souvent appelé glace, Il est obtenu en réduisant sa température à 0°C ou moins. L'une des bizarreries de l'eau gelée est qu'elle ajoute du volume par rapport à la forme liquide. Autrement dit, la glace est moins dense que l'eau (c'est pourquoi la glace flotte).
L'apparence de la glace est dure, cassante et transparente, et varie du blanc au bleu, selon la pureté et l'épaisseur de la couche. Sous certaines conditions, peut rester temporairement dans un état semi-solide appelé neige.
L'eau solide se trouve couramment dans les glaciers, les sommets des montagnes, le pergélisol (pergélisol) et les planètes extérieures du système solaire et dans nos congélateurs alimentaires.
Gazeux
L'état gazeux de l'eau, appelé vapeur ou vapeur d'eau, c'est un composant commun de notre atmosphère et est même présent dans chaque respiration que nous prenons. A basse pression ou à haute température, l'eau s'évapore et a tendance à monter car la vapeur d'eau est moins dense que l'air.
Tant que l'on est au niveau de la mer (1 atmosphère), le passage à l'état gazeux se fait à 100°C. L'eau gazeuse forme les nuages que nous voyons dans le ciel, se trouve dans l'air que nous respirons (en particulier notre expiration) et dans le brouillard qui apparaît les jours froids et humides. Si nous mettons une casserole d'eau à bouillir, nous pouvons également le voir.
Modifications de l'état de l'eau
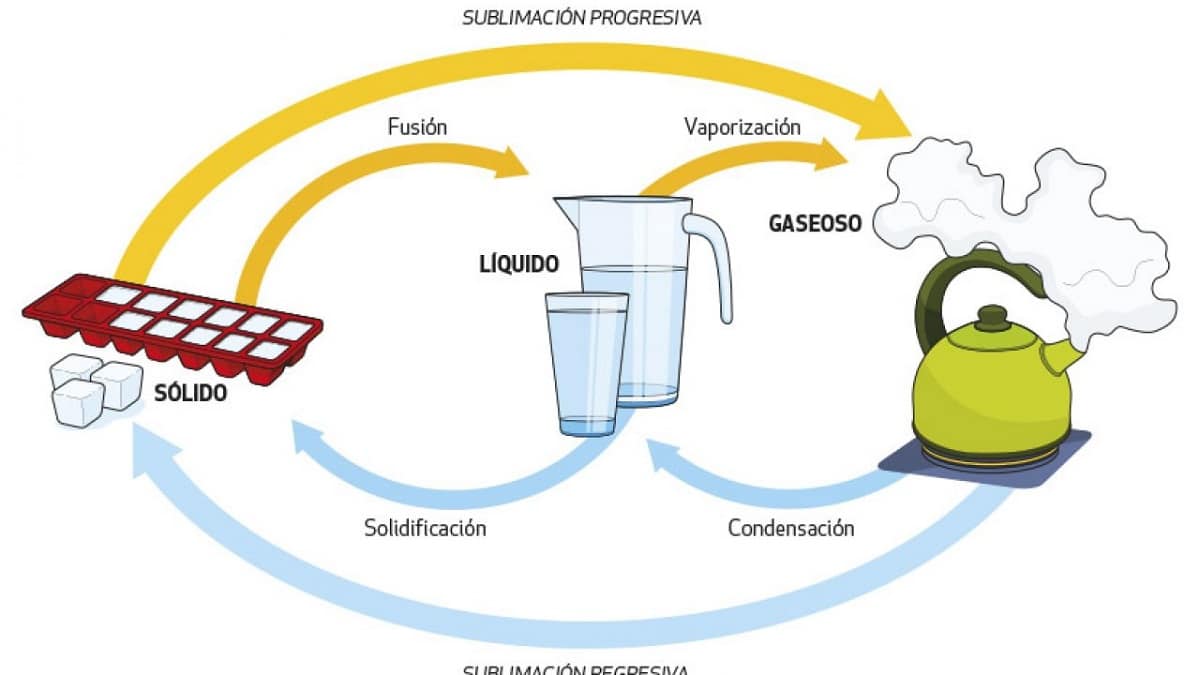
Comme nous l'avons vu dans certains des cas précédents, l'eau peut passer d'un état à un autre simplement en changeant ses conditions de température. Cela peut être fait dans un sens ou dans l'autre, et nous donnerons à chaque processus différent son propre nom :
- Évaporation. Le passage du liquide au gaz augmente la température de l'eau à 100°C. C'est ce qui se passe avec l'eau bouillante, c'est pourquoi elle se caractérise par des bulles.
- Condensation. Transformation de gazeux en liquide par perte de chaleur. C'est ce qui se passe lorsque la vapeur d'eau se condense sur un miroir de salle de bain : la surface du miroir est plus froide et la vapeur qui s'y dépose devient liquide.
- Gelé. Le passage du liquide au solide abaisse la température de l'eau en dessous de 0°C. L'eau gèle, créant de la glace, comme elle le fait dans nos réfrigérateurs ou sur les sommets des montagnes.
- Fusion: transforme l'eau solide en liquide, la chaleur en glace. Ce processus est courant et peut être observé lorsque nous ajoutons de la glace à une boisson.
- Sublimation. Le processus de passage d'un état gazeux à un état solide, dans ce cas de la vapeur d'eau directement à la glace ou à la neige. Pour que cela se produise, des conditions de température et de pression très spécifiques sont nécessaires, c'est pourquoi ce phénomène se produit au sommet des montagnes, par exemple lors de la sécheresse en Antarctique, où il n'y a pas d'eau liquide.
- Sublimation inversée : Conversion directe d'un solide en gaz, c'est-à-dire de la glace en vapeur. On peut le voir dans des environnements très secs, comme la toundra polaire elle-même ou les sommets des montagnes, où à mesure que le rayonnement solaire augmente, la majeure partie de la glace se sublime directement en gaz sans passer par une phase liquide.
J'espère qu'avec ces informations, vous pourrez en apprendre davantage sur les états de l'eau et ses caractéristiques.