
Keemiline muutus on aine muutus, mis muudab selle keemilist struktuuri, st muudab selle omadusi, mitte ainult kuju. See tähendab, et keemiline muutus, tuntud ka kui keemiline reaktsioon või keemiline nähtus, hõlmab keemiliste sidemete katkemist ja moodustumist ühes aines või ühendis, et moodustada uus aine või ühend. Neid on arvukalt keemilised muutused maailmas.
Sel põhjusel pühendame selle artikli teile, millised on peamised olemasolevad keemilised muutused ja nende näide.
Mis on keemilised muutused?

Kui kaks või enam ainet (nn reaktiivid või reagentid) läbivad keemilise reaktsiooni, muutes selle käigus nende keemilist struktuuri ja olles võimelised tarbima (endotermilised reaktsioonid) või vabastavad (eksotermilised reaktsioonid) energiat, tekitades kaks või enam ainet (nimetatakse tooteks). Mõned keemilised reaktsioonid on inimestele ohtlikud, kuna need võivad sisaldada või tekitada toksilisi või söövitavaid ühendeid. Muud reaktsioonid, näiteks teatud eksotermilised reaktsioonid, võivad põhjustada plahvatusi.
Keemiatööstuses toodetakse paljusid materjale, mida me oma igapäevaelus kasutame, kontrollitud keemiliste reaktsioonide kaudu. Mõned reaktsioonid toimuvad spontaanselt, teised peavad tekitama inimesed tehastes või keemialaborites. Keemilise reaktsiooni toimumiseks kulub teatud ajavahemik. sõltuvalt reagentide olemusest ja reaktsiooni toimumise tingimustest.
Seetõttu on keemiliste reaktsioonide kiirust mõjutavad tegurid üldiselt järgmised:
- Temperatuur tõuseb. Temperatuuri tõus kipub suurendama keemilise reaktsiooni kiirust.
- suurenenud rõhk. Rõhu tõstmine suurendab üldiselt keemilise reaktsiooni kiirust. See juhtub tavaliselt siis, kui reageerivad rõhumuutustele tundlikud ained, näiteks gaasid. Vedelike ja tahkete ainete puhul ei põhjusta rõhumuutused nende reaktsioonikiirustes olulisi muutusi.
- Reaktiivi agregatsiooni olek. Tahked ained reageerivad üldiselt aeglasemalt kui vedelikud või gaasid, kuigi kiirus sõltub ka iga aine reaktsioonivõimest.
- Katalüsaatori kasutamine. Need on ained, mida kasutatakse keemiliste reaktsioonide kiiruse suurendamiseks. Need ained ei sega reaktsiooni, nad lihtsalt kontrollivad reaktsiooni toimumise kiirust. On ka aineid, mida nimetatakse inhibiitoriteks, mida kasutatakse samamoodi, kuid millel on vastupidine toime, aeglustades reaktsiooni.
- valguse energia. Mõned keemilised reaktsioonid kiirenevad, kui neile langeb valgus.
- Reaktiivi kontsentratsioon. Enamik keemilisi reaktsioone toimub kiiremini, kui reagentide kontsentratsioon on kõrge.
Näited keemilistest muutustest
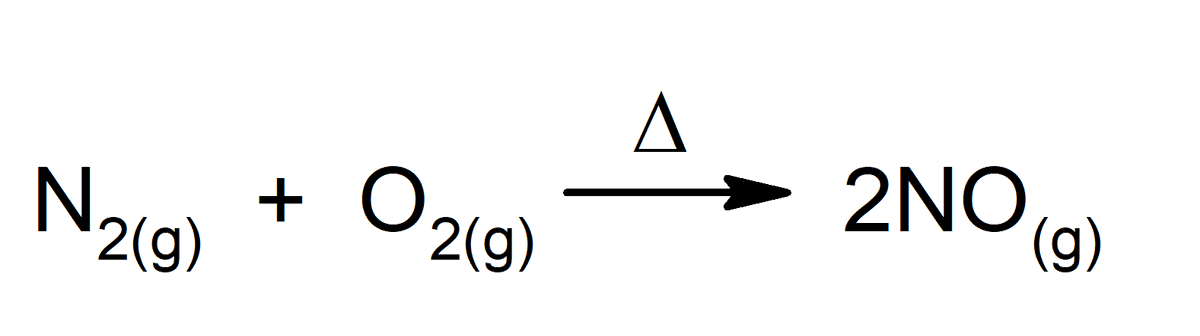
Igasugune keemiline reaktsioon on suurepärane näide keemilisest muutusest, isegi need, mis toimuvad meie kehas. Mõned näited on järgmised:
- Hingamine. See on keemiliselt muudetud bioloogiline protsess, mille käigus võetakse õhust hapnikku ja seda kasutatakse toidust saadava glükoosiga reageerimiseks, tekitades kõrgel tasemel keemilist energiat (ATP) ja suures koguses süsinikdioksiidi jääkaineid (CO2). eritub.
- Happevihm. See esineb tugeva õhusaastega keskkondades. Tavaliselt on see pilvedesse kogunenud vee ja teiste õhus hajuvate gaaside vahelise keemilise muutuse tulemus, mille vääveloksiidi või lämmastikoksiidi sisaldus tekitab väävelhapet või lämmastikhapet, mis langeb koos vihmaveega soolaks. Aku sees toimuv reaktsioon toimub happe ja metalli vahel. Näiteks pliid ja väävelhapet kasutav aku toodab plii (II) sulfaati, valget soola. Osooni lagunemine. Osoonimolekulid lagunevad mingisuguse valguse mõjul hapnikumolekulideks.
Keemilised muutused ja füüsikalised muutused

Aine füüsikalised muutused ei muuda selle koostist, see tähendab, et nad ei muuda aine keemilist struktuuri, seega ei saa aineid laguneda ega moodustada füüsikaliste muutustega. Füüsikaline muutus muudab lihtsalt aine füüsikalisi omadusi, nagu kuju, tihedus ja agregatsiooni olek (tahke, vedel, gaas). Füüsilised muutused seevastu Need on tavaliselt pöörduvad, kuna muudavad aine kuju või olekut, kuid mitte selle koostist.
Näiteks kui vesi keeb, saame vedeliku muuta gaasiks, kuid tekkiv aur koosneb ikkagi veemolekulidest. Ja vastupidi, kui me külmutame vee, muutub see tahkeks, kuid on siiski keemiliselt sama aine.
Teine näide on veeldatud gaas, mida kasutame oma sigaretisüütajates, tavaliselt butaan (C4H10) või propaan (C3H8), mis kõrgsurve mõjul muutub vedelaks, kuid ei muuda selle keemilist koostist.
Keemiline muutus muudab aatomite paigutust ja sidet aines nii, et need ühinevad erineval viisil, mille tulemuseks on algsest erinev aine. Kui toimub keemiline muutus, saate alati sama koguse ainet, millega alustasite, isegi kui see on erinevas vahekorras, sest ainet ei saa luua ega hävitada, vaid ainult transformeerida.
Näiteks kui me reageerime vee (H2O) ja kaaliumiga (K), saame kaks uut ainet: kaaliumhüdroksiid (KOH) ja vesinikgaas (H2). See on reaktsioon, mis üldiselt vabastab palju energiat ja on seetõttu väga ohtlik.
Näited aine keemilistest muutustest
Küpsiste või kookide küpsetamine
Levinud asjad nagu küpsised, koogid, koogid jne. peita keemiline reaktsioon, mida nimetatakse kääritamiseks, mille käigus tainas kerkib pärmi tekitatud gaaside tõttu. Leiva valmistamisel muudab pärm tärklise glükoosiks.
Seedimine
Toidu seedimine on ilmselge näide aine keemilisest muutumisest hüdrolüüsi teel (orgaanilise aine lagunemine vee toimel). Toit, mida me sööme puuviljade, köögiviljade, liha jne kujul, nad läbivad maomahlaga segunemise protsessi, et toitaineid paremini omastada ja muuta need vastavalt organismi vajadustele erinevateks aineteks.
Samas protsessis eemaldatakse organismist üleliigsed elemendid ehk toksiinid algsest erineval viisil; väljaheidete, uriini, higi jne kujul.
pulque
Käärimine on kataboolne protsess, mille käigus glükoosimolekulid lagunevad hapnikupuuduse tõttu. Mõned käärimisprotsessis saadavad alkohoolsed joogid on siider, õlu ja pehme vein, millest viimane on üks vähemtuntud jooke maailmas. Pulque saadakse agaavitaimest käsitööndusliku protsessi abill, milles aine küpsemine on võtmetähtsusega, et saada lõpptoode, mis on valge, hapu ja viskoosne, väga spetsiifilise maitsega, mis ei sobi ühelegi maitsele.
Käärimine toimub ka muu hulgas leiva, jogurti ja juustu valmistamisel.
caramelo
Karamell on põhinäide aine keemilisest muutumisest, kuna tahke valge suhkur muutub mõne minuti jooksul kuumutamisel merevaigukarva ja meeldiva aroomiga kleebiseks. Ehk siis genereeritakse originaalist täiesti erinev toode.
Loodan, et selle teabe abil saate rohkem teada keemiliste muutuste ja nende näidete kohta.