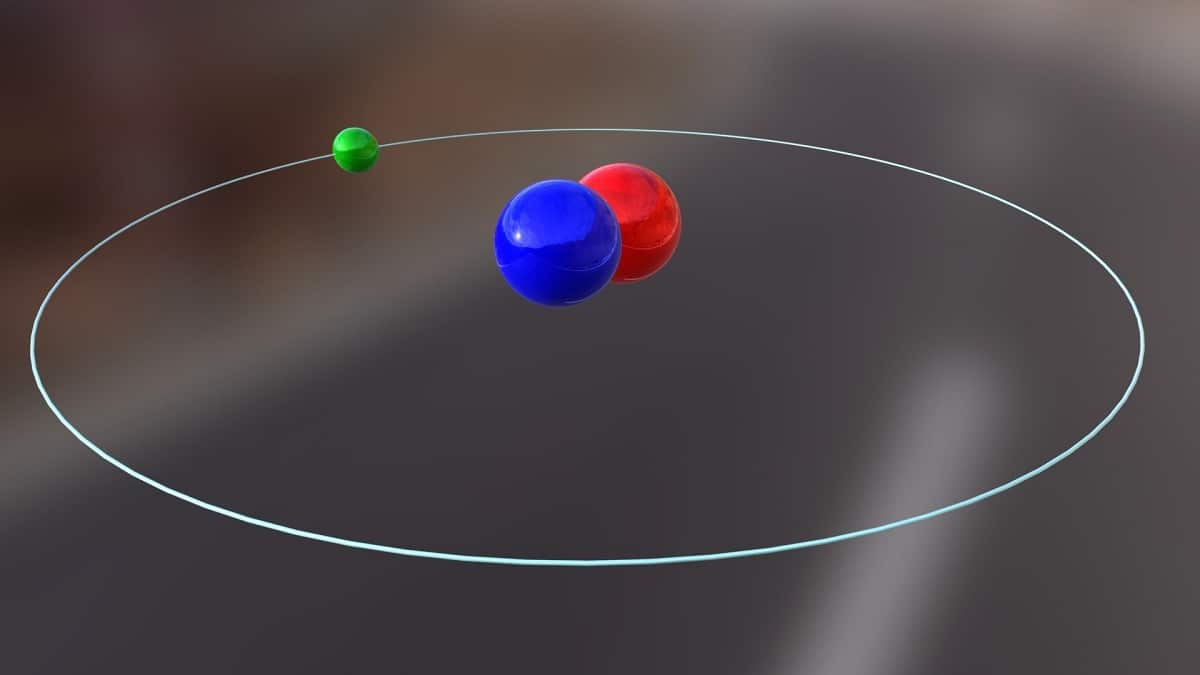
Täna räägime isotoopist, mida kasutatakse tuumaenergia tootmiseks. See on umbes deuteerium. See on üks vesiniku isotoopliikidest ja seda tähistab sümbol D või 2H. Sellele on antud üldnimetus raske vesinik, kuna mass on prootoni massist kaks korda suurem. Isotoop pole midagi muud kui liik, mis pärineb samast keemilisest elemendist, kuid millel on erinev massinumber. Deuteeriumit kasutatakse erinevatel eesmärkidel.
Sel põhjusel pühendame selle artikli teile deuteeriumi kõigi omaduste, struktuuri, omaduste ja kasutamise kirjeldamiseks.
põhijooned
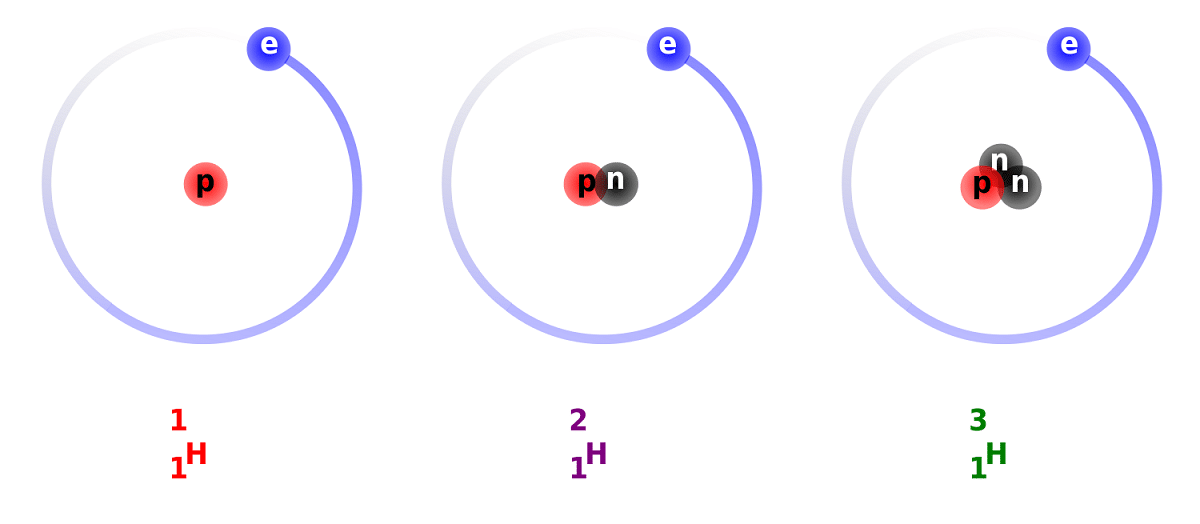
Deuteeriumi ja vesiniku eristamine tuleneb selles olevate neutronite arvu erinevusest. Sel põhjusel peetakse deuteeriumit stabiilseks isotoopiks ja seda võib leida täiesti looduslikku päritolu vesiniku moodustunud ühendites. Tuleb arvestada, et kuigi need on looduslikku päritolu, esinevad nad väikeses osas. Arvestades omadusi, mis on nii tavalise vesinikuga sarnased, saab selle tervikuna asendada reaktsioonides, milles ta osaleb. Sel viisil saab selle muuta ekvivalentseteks aineteks.
Sel ja muudel põhjustel on deuteeriumil palju rakendusi erinevates teadusvaldkondades. Sellest on aastate jooksul saanud teaduse ning tehnoloogia ja teabe edusammude üks olulisemaid elemente.
Selle isotoobi põhistruktuur koosneb tuumast, millel on prooton ja neutron. Selle aatommass on umbes 2,014 grammi. See isotoop avastati tänu Ameerika Ühendriikide keemikule Harold C. Ureyle ning tema kaastöötajatele Ferdinand Brickwedde ja George Murphy'le 1931. aastal. Ettevalmistus deuteeriumiga puhtal kujul kohtumiseks viidi esimest korda edukalt läbi 1933. aastal. Juba 50. aastatel hakati kasutama liitiumdeuteriidina tuntud tahket faasi, mis näitas suurt stabiilsust. See aine võib deuteeriumi ja triitiumi asendada paljudes keemilistes reaktsioonides.
Teaduse areng toimub siis, kui leitakse aine, mis võib hõlbustada keemilisi reaktsioone toodete loomisel. Selles mõttes, kui uuriksite selle isotoobi arvukust, et oleksite võimelised teatud asju jälgima. On teada, et deuteeriumi osakaal vees varieerub sõltuvalt proovi võtmise alast. On mõned spektroskoopia uuringud, mis on määranud selle isotoobi olemasolu teistel meie galaktika planeetidel. See võib olla väga oluline teiste taevakehade koostise uurimiseks.
Deuteeriumi struktuur ja päritolu

Me teame mõningaid fakte deuteeriumi kohta. Nagu me varem mainisime, seisneb vesiniku isotoopide peamine erinevus nende struktuuris. Ja kas vesinikul, deuteeriumil ja triitiumil on erinev kogus prootoneid ja neutroneid, seega on neil erinevad keemilised omadused. Pean ka meeles pidama, et teiste tähekehade sees olev deuteerium elimineeritakse suurema kiirusega kui see on tekkinud. See on üks põhjus, miks deuteeriumi esinemist tähekehades on nii raske uurida.
Muude loodusnähtuste hulka kuulub väike kogus deuteeriumit, seega tekitab selle tootmine tänapäeval endiselt märkimisväärset huvi. Alates protsendist, mida oleme varem maininud deuteeriumi esinemise kohta looduses, see ei moodusta 0.02%. Rida teaduslikke uuringuid on näidanud, et valdav osa deuteeriumist moodustunud aatomitest pärines looduslikult plahvatusest, mis põhjustas universumi päritolu Big Bang. Need on üks peamisi põhjuseid, miks arvatakse, et deuteerium esineb suurtel planeetidel nagu Jupiter.
Kõige tavalisem viis selle isotoobi loomulikuks saamiseks on siis, kui need on ühendatud vesinikuga. Kui see juhtub, ühendatakse see protiumi kujul. Teadlased on huvitatud teada suhtest, mis on loodud nende osakaalu vahel deuteerium ja vesinik erinevates teadusvaldkondades. Seda uuritakse laialdaselt sellistes teadusharudes nagu astronoomia või klimatoloogia. Nendes harudes on universumi ja meie atmosfääri tundmiseks ja mõistmiseks mõned praktilised teenused.
Deuteeriumi omadused

Saame teada, millised on selle vesinikule kuuluva isotoobi peamised omadused. Kõigepealt on teada, mis on radioaktiivsetest omadustest vaba isotoop. See tähendab, et see on oma olemuselt üsna stabiilne. Seda saab kasutada vesiniku asendamiseks erinevates keemilistes reaktsioonides. Loomulikult suure stabiilsusega näitab tavalisest vesinikust erinevat käitumist. See juhtub kõigis biokeemilist laadi reaktsioonides. Enne asendamist on vaja teada, et kuigi keemiliste reaktsioonide korral on vesiniku vahetamine deuteeriumiks võimalik, tuleb teada, et nende käitumine on erinev.
Kui kaks vesiniku aatomit vees asendatakse, võib saada ühendi, mida nimetatakse raskeks veeks. Vesinik, mis esineb ookeanis ja on deuteeriumi kujul selle osakaal protiumi suhtes on ainult 0,016%. Universumis on sellel isotoopil kalduvus heeliumi tekitamiseks kiiremini sulanduda. Kui ühendame deuteeriumi aatomhapnikuga, näeme, et sellest saab mürgine liik. Vaatamata sellele ja keemilistele omadustele või väga sarnased vesiniku omadega.
Selle isotoobi teine omadus on see, et kui deuteeriumi aatomid allutatakse tuumasünteesiprotsessile kõrgel temperatuuril, võib vabaneda suures koguses energiat. See on väljaränne, mida olete uurinud, et saaksite implanteerida meie planeedi tuumasünteesi. Mõned füüsikalised omadused nagu keemistemperatuur, aurustumissoojus, kolmikpunkt ja tihedus nende suurus on suurem kui vesinikul.
Loodan, et selle teabe abil saate rohkem teada deuteeriumi ja selle omaduste kohta.