
Kas olete kunagi näinud Bohri aatomimudel. See on üsna oluline avastus, mille see teadlane teaduse, eriti elektromagnetismi ja elektrokeemia jaoks tegi. Varem oli seal Rutherfordi mudel, mis oli üsna revolutsiooniline ja väga edukas, kuid oli mõningaid vastuolusid teiste aatomiseadustega, näiteks Maxwelli ja Newtoni seadustega.
Selles artiklis räägime teile kõik, mida peate teadma Bohri aatomimudeli kohta, samuti selle üksikasjad, et selgitada selles küsimuses tekkivaid kahtlusi.
Probleemid, mida see aitas lahendada
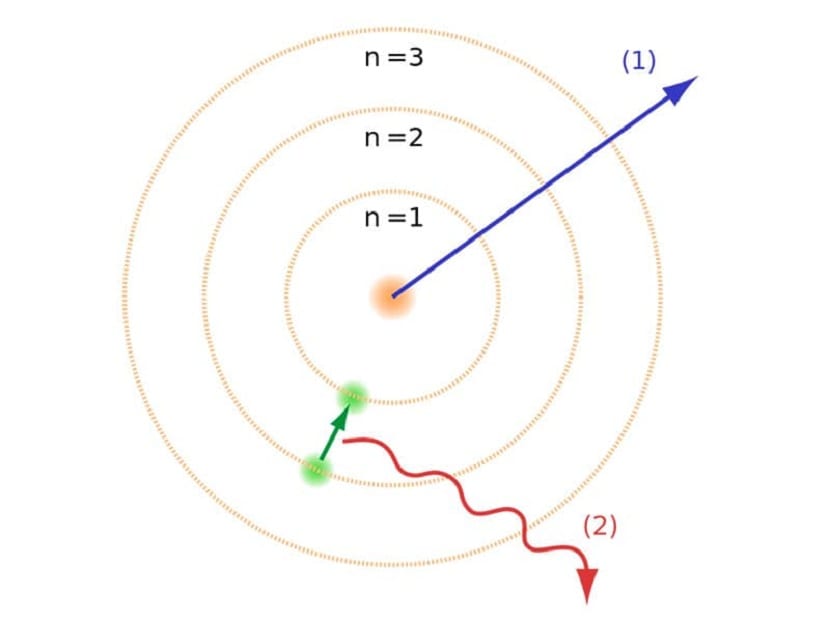
Nagu me artikli alguses mainisime, aitas see aatomimudel lahendada teatud konflikte, mis eksisteerisid teiste aatomiseadustega. Eelmises Rutherfordi mudelis pidime seda tegema negatiivse elektrilaenguga liikuvad elektronid pidid kiirgama teatud tüüpi elektromagnetilist kiirgust. See peaks olema täidetud elektromagnetismi seaduste tõttu. See energiakadu põhjustab elektronide vähendamise orbiidile, keerates selle keskpunkti suunas. Kesklinna jõudes varisesid nad kokku, põrkudes kokku südamikuga.
See tekitas teoreetiliselt probleemi, kuna see ei saanud aatomite tuumaga kokku kukkuda, kuid elektronide trajektoor pidi olema erinev. See lahendati Bohri aatomimudeliga. See seletab seda elektronid tiirlevad tuuma ümber teatud lubatud orbiitidel ja millel on spetsiifiline energia. Energia on proportsionaalne Plancki konstandiga.
Neid orbiite, mida oleme maininud, kus elektronid liiguvad, nimetati energiakihtideks või energiatasanditeks. See tähendab, et energia, mis elektronidel on, ei ole alati sama, vaid on kvantiseeritud. Kvanttasemed on erinevad orbiidid, milles aatomid leiduvad. Sõltuvalt sellest, millisel orbiidil see igal ajahetkel asub, on sellel energiat rohkem või vähem. Aatomi tuumale lähemal asuvatel orbiitidel on suurem energiakogus. Teiselt poolt, mida rohkem nad tuumast eemalduvad, seda vähem energiat.
Energiataseme mudel
See Bohri aatomimudel, mis tähendas, et elektronid võivad energiat saada või kaotada ainult ühelt orbiidilt teisele hüpates, aitas lahendada Rutherfordi mudeli pakutud varingu. Ühelt energiatasandilt teisele liikudes neelab või kiirgab see elektromagnetilist kiirgust. See tähendab, et kui hüpate rohkem laetud energiatasemelt vähem laetud tasemele, vabastate liigse energia. Ja vastupidi, kui see läheb madalalt energiatasemelt kõrgemale, neelab see elektromagnetkiirgust.
Kuna see aatomimudel on Rutherfordi mudeli modifikatsioon, säilivad väikese kesktuuma ja suurema osa aatomi massiga omadused. Ehkki elektronide orbiidid ei ole planeetide tasased, võiks öelda, et need elektronid pöörlevad oma tuuma ümber sarnaselt planeetide ümber Päikese.
Bohri aatomimudeli põhimõtted

Analüüsime nüüd selle aatomimudeli põhimõtteid. See on nimetatud mudeli ja selle toimimise üksikasjalik selgitus.
- Osakesed, millel on positiivne laeng Need on aatomi kogumahuga võrreldes madalas kontsentratsioonis.
- Negatiivse elektrilaenguga elektronid on need, mis leitakse tuuma ümber ringikujulistel orbiitidel.
- Seal on orbiidide energiatasemed, mille kaudu elektronid ringlevad. Neil on ka määratud suurus, nii et orbiitide vahel pole vahepealset olekut. Nad lihtsalt liiguvad ühelt tasemelt teisele.
- Igal orbiidil olev energia on seotud selle suurusega. Mida kaugemal on orbiit aatomi tuumast, seda rohkem on sellel energiat.
- Energiatase on erineva elektronide arvuga. Mida madalam on energiatase, seda vähem elektrone see sisaldab. Näiteks kui oleme esimesel tasemel, on seal kuni kaks elektroni. 2. tasemel võib olla kuni 8 elektroni jne.
- Kui elektronid liiguvad ühelt orbiidilt teisele, neelavad või vabastavad nad elektromagnetilist energiat. Kui minna ühelt energeetilisemalt tasandilt teisele vähem, vabastate liigse energia ja vastupidi.
See mudel oli revolutsiooniline ja püüdis anda materjalile stabiilsust, mida eelmistel mudelitel polnud. Selle aatomimudeliga selgitati ka gaaside diskreetset emissiooni ja neeldumisspektrit. See oli esimene mudel, mis tutvustas kvantimise või kvantimise mõistet. See muudab Bohri aatomimudeli mudeliks, mis on klassikalise mehaanika ja kvantmehaanika vahel poolel teel. Kuigi see puudub ka, oli see Schrödingeri ja teiste teadlaste hilisema kvantmehaanika eelkäija mudel.
Bohri aatomimudeli piirangud ja vead
Nagu me mainisime, on sellel mudelil ka teatud puudused ja vead. Esiteks ei selgita ega põhjendata, miks elektronid peavad piirduma ainult konkreetsete orbiitidega. See eeldab otseselt, et elektronide raadius ja orbiit on teada. Kuid see pole nii. Kümme aastat hiljem Heisenbergi ebakindluse põhimõte lükkas selle ümber.
Kuigi see aatomimudel suutis modelleerida elektronide käitumist vesiniku aatomites, polnud see suurema täpsusega elektronide arvuga elementide osas nii täpne. See on mudel, mis on probleeme Zeemani efekti selgitamisega. Seda efekti saab näha, kui spektrijooned jagatakse välise ja staatilise magnetvälja olemasolul kaheks või enamaks.
Selle mudeli teine viga ja piirang on see, et see annab põhise orbiidi nurga impulssile vale väärtuse. Kõik need mainitud vead ja piirangud muudavad Bohri aatomimudeli aastaid hiljem kvantteooriaga asendatuks.
Loodan, et selle artikliga saate rohkem teada Bohri aatomimudeli ja selle rakenduste kohta teaduses.