
La Νόμος του Μπόιλ ανακαλύφθηκε από τον Robert Boyle τον XNUMXο αιώνα και έθεσε τα θεμέλια για να εξηγήσει τη σχέση μεταξύ πίεσης και όγκου που υπάρχει στα αέρια. Μέσα από μια σειρά πειραμάτων, κατάφερε να δείξει ότι αν η θερμοκρασία είναι σταθερή, ένα αέριο μειώνει τον όγκο του όταν υποβάλλεται σε μεγαλύτερη πίεση και αυξάνεται σε όγκο εάν η πίεση μειωθεί.
Σε αυτό το άρθρο θα σας πούμε όλα όσα πρέπει να γνωρίζετε για το νόμο του Boyle, τα χαρακτηριστικά και τη σημασία του.
Κύρια χαρακτηριστικά
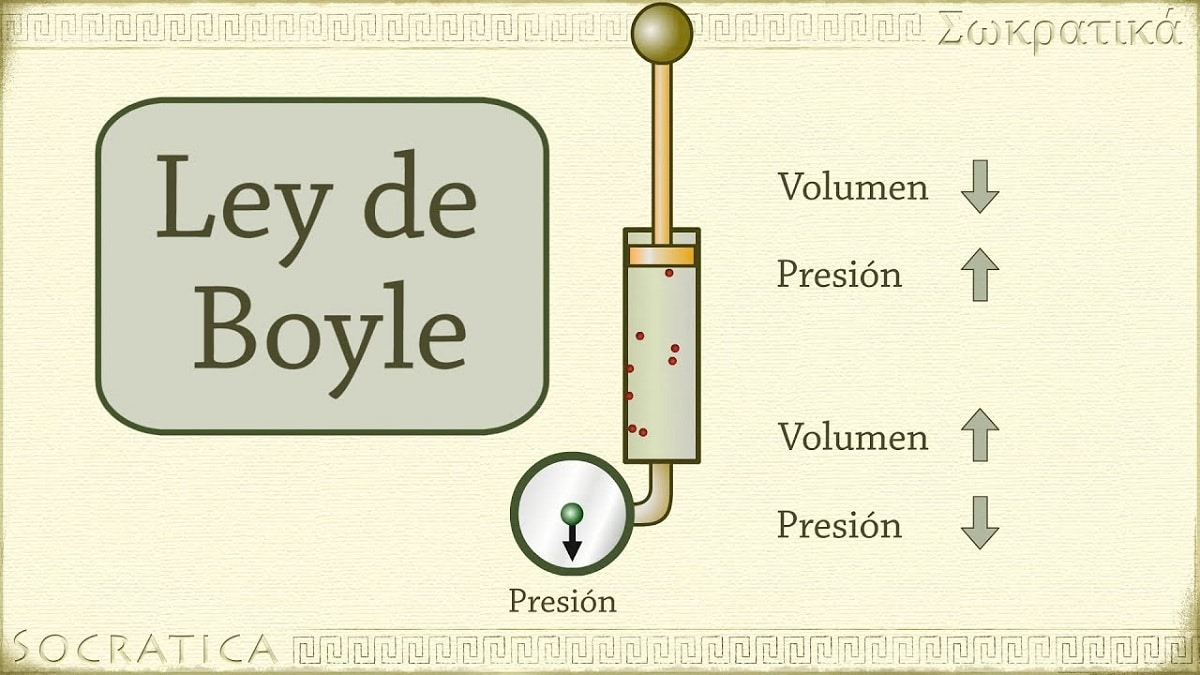
Το 1662, ο Robert Boyle ανακάλυψε ότι η πίεση που ασκείται σε ένα αέριο είναι αντιστρόφως ανάλογη με τον όγκο και τον αριθμό των γραμμομορίων του σε σταθερή θερμοκρασία. Με άλλα λόγια, εάν η πίεση που ασκείται σε ένα αέριο διπλασιαστεί, το ίδιο αέριο θα συμπιεστεί και ο όγκος του θα μειωθεί στο μισό.
Καθώς αυξάνεται ο όγκος του δοχείου που περιέχει το αέριο, αυξάνεται επίσης η απόσταση που πρέπει να διανύσουν τα σωματίδια πριν συγκρουστούν με τα τοιχώματα του δοχείου. Αυτή η αύξηση της απόστασης επιτρέπει τη μείωση της συχνότητας των κραδασμών, επομένως η πίεση στον τοίχο είναι μικρότερη από πριν όταν ο όγκος ήταν μικρότερος.
Ο νόμος του Μπόιλ ανακαλύφθηκε για πρώτη φορά το 1662 από τον Ρόμπερτ Μπόιλ. Η Edme Mariotte ήταν ένας άλλος επιστήμονας που σκέφτηκε και κατέληξε στα ίδια συμπεράσματα με τον Boyle, ωστόσο, ο Mariotte δημοσιοποίησε το έργο του μέχρι το 1676. Γι' αυτό σε πολλά βιβλία βρίσκουμε αυτόν τον νόμο που ονομάζεται Boyle and Mariot's Law Νόμος του Boyle-Mariot, γνωστός και ως Νόμος του Mattut, που αναπτύχθηκε από τον Βρετανό φυσικό και χημικό Robert. Διατυπώθηκε ανεξάρτητα από τον Boyle και τον Γάλλο φυσικό και βοτανολόγο Edmé Mattout.
Αναφέρεται σε έναν από τους νόμους που συσχετίζουν τον όγκο και την πίεση ενός αερίου με μια ορισμένη ποσότητα αερίου που διατηρείται σε σταθερή θερμοκρασία. Ο νόμος του Boyle αναφέρει τα εξής: Η πίεση που ασκείται από μια δύναμη είναι φυσικά αντιστρόφως ανάλογη με τον όγκο της αέριας ύλης εφόσον η θερμοκρασία της παραμένει σταθερή. Ή πιο απλά, μπορούμε να το ερμηνεύσουμε ως εξής: σε υψηλότερη σταθερή θερμοκρασία, ο όγκος μιας σταθερής μάζας αερίου είναι αντιστρόφως ανάλογος της σταθερής πίεσης που ασκεί.
Πειράματα και εφαρμογές του νόμου του Boyle

Για να αποδείξει τη θεωρία του νόμου του Boyle, ο Mariot ήταν υπεύθυνος για την εισαγωγή αερίου σε έναν κύλινδρο με ένα έμβολο και ήταν σε θέση να επαληθεύσει τις διαφορετικές πιέσεις που δημιουργήθηκαν καθώς το έμβολο κατέβαινε. Από αυτό το πείραμα συνάγεται ότι όσο αυξάνεται ο όγκος, η πίεση μειώνεται.
Ο νόμος του Boyle έχει πολλές εφαρμογές στη σύγχρονη ζωή, μεταξύ των οποίων μπορούμε να αναφέρουμε για παράδειγμα την κατάδυση, γιατί ο δύτης πρέπει να διώξει τον αέρα από τους πνεύμονές του όταν ανεβαίνει γιατί διαστέλλεται όταν η πίεση μειώνεται, αν δεν το κάνει μπορεί να προκαλέσει βλάβη στους ιστούς.
Βρίσκεται σε όλο τον εξοπλισμό που χρησιμοποιεί ή τροφοδοτείται από πνευματική ισχύ, όπως ρομποτικοί βραχίονες που χρησιμοποιούν εξαρτήματα όπως πνευματικά έμβολα, ενεργοποιητές, ρυθμιστές πίεσης και βαλβίδες εκτόνωσης πίεσης.
Οι κινητήρες βενζίνης, αερίου ή ντίζελ χρησιμοποιούν επίσης τον νόμο του Boyle κατά την εσωτερική καύση, επειδή την πρώτη φορά που εισέρχεται αέρας στον κύλινδρο με όγκο και πίεση, τη δεύτερη φορά μειώνει τον όγκο αυξάνοντας την πίεση.
Τα αυτοκίνητα διαθέτουν συστήματα αερόσακων που λειτουργούν με την αποβολή ορισμένης ποσότητας αέρα ή αερίου από έναν θάλαμο που φτάνει στον εξωτερικό αερόσακο, όπου η πίεση μειώνεται και ο όγκος αυξάνεται διατηρώντας σταθερή θερμοκρασία.
Ο νόμος του Μπόιλ είναι πολύ σημαντικός σήμερα γιατί είναι ο νόμος που μας μιλά και εξηγεί τη συμπεριφορά των αερίων. Εξηγεί οπωσδήποτε ότι η πίεση και ο όγκος ενός αερίου είναι αντιστρόφως ανάλογες μεταξύ τους. Επομένως, όταν ασκείται πίεση σε ένα αέριο, ο όγκος του μειώνεται και η πίεσή του αυξάνεται.
ιδανικό μοντέλο αερίου

Ο νόμος Boyle-Mariotte εφαρμόζεται στα λεγόμενα ιδανικά αέρια, ένα θεωρητικό μοντέλο που απλοποιεί σημαντικά τη συμπεριφορά οποιουδήποτε αερίου, υποθέτοντας:
- μόρια αερίου είναι τόσο μικρά που δεν χρειάζεται να σκεφτούμε το μέγεθός τους, ειδικά αν σκεφτεί κανείς ότι αυτή είναι πολύ μικρότερη από την απόσταση που διανύουν.
- Επιπλέον, τα μόρια μετά βίας αλληλεπιδρούν, εκτός από τις περιπτώσεις που συγκρούονται πολύ σύντομα, και όταν συγκρούονται, η σύγκρουση είναι ελαστική, επομένως διατηρείται τόσο η ορμή όσο και η κινητική ενέργεια.
- Τέλος, ας υποθέσουμε ότι αυτή η κινητική ενέργεια είναι ανάλογη με τη θερμοκρασία του αέριου δείγματος, δηλαδή όσο περισσότερο αναδεύονται τα σωματίδια, τόσο υψηλότερη είναι η θερμοκρασία.
Τα ελαφρά αέρια, ανεξάρτητα από την ταυτότητά τους, ακολουθούν αυτές τις οδηγίες πολύ αυστηρά υπό τυπικές συνθήκες θερμοκρασίας και πίεσης (δηλ.: 0ºC και ατμοσφαιρική πίεση (1 ατμόσφαιρα). Για αυτά τα αέρια, ο νόμος Boyle-Mariotte περιγράφει τη συμπεριφορά τους με μεγάλη ακρίβεια. .
Εφόσον το P∙V είναι σταθερό σε μια δεδομένη θερμοκρασία, εάν η πίεση του αερίου αλλάξει, ο όγκος αλλάζει έτσι ώστε το γινόμενο να παραμένει το ίδιο, επομένως σε δύο διαφορετικές καταστάσεις 1 και 2, η ισότητα μπορεί να εκφραστεί ως εξής:
P1∙V1 = P2∙V2
Στη συνέχεια, γνωρίζοντας μια κατάσταση, συν μια μεταβλητή από την άλλη κατάσταση, μπορείτε να γνωρίζετε τη μεταβλητή που λείπει αφαιρώντας την από τον νόμο Boyle-Mariot.
Ιστορία του νόμου του Boyle
Βρετανός χημικός. Πρωτοπόρος πειραμάτων στον τομέα της χημείας, ιδιαίτερα στις ιδιότητες των αερίων,
Η διατριβή του Robert Boyle για τη συμπεριφορά της ύλης σε επίπεδο σωματιδίων ήταν ένας πρόδρομος της σύγχρονης θεωρίας των χημικών στοιχείων. Ήταν επίσης ιδρυτικό μέλος της Βασιλικής Εταιρείας του Λονδίνου.
Ο Robert Boyle γεννήθηκε σε μια οικογένεια ευγενών στην Ιρλανδία και φοίτησε στα καλύτερα αγγλικά και ευρωπαϊκά σχολεία. Από το 1656 έως το 1668 υπηρέτησε ως βοηθός του Ρόμπερτ Χουκ στο Πανεπιστήμιο της Οξφόρδης, συνεργαζόμενος μαζί του σε μια σειρά πειραμάτων που καθόρισαν τις φυσικές ιδιότητες του αέρα και τον τρόπο με τον οποίο καίει, αναπνέει και μεταδίδει τον ήχο.
Τα αποτελέσματα αυτών των συνεισφορών συγκεντρώθηκαν σε αυτά «Νέα φυσικομηχανικά πειράματα για την ελαστικότητα του αέρα και τις επιπτώσεις του» (1660). Στη δεύτερη έκδοση αυτού του έργου (1662), αποκάλυψε τη διάσημη ιδιότητα των αερίων, τον νόμο Boyle-Mariotte, ο οποίος έλεγε ότι ο όγκος που καταλαμβάνει ένα αέριο σε σταθερή θερμοκρασία είναι αντιστρόφως ανάλογος της πίεσής του. Σήμερα είναι γνωστό ότι αυτός ο νόμος εκπληρώνεται μόνο όταν γίνει αποδεκτή η θεωρητική ιδανική συμπεριφορά των αερίων.
Ελπίζω ότι με αυτές τις πληροφορίες μπορείτε να μάθετε περισσότερα για το νόμο του Boyle, τα χαρακτηριστικά και τις εφαρμογές του στον κόσμο της επιστήμης.