In der Welt der Physik gibt es einen Zweig, der für die Untersuchung der Transformationen verantwortlich ist, die durch Wärme und Arbeit in einem System erzeugt werden. Es geht um die Thermodynamik. Es ist ein Zweig der Physik, der für die Untersuchung aller Transformationen verantwortlich ist, die nur aus Prozessen resultieren, bei denen sich die Zustandsvariablen von Temperatur und Energie auf makroskopischer Ebene ändern.
In diesem Artikel erklären wir Ihnen alles, was Sie über Thermodynamik und die Prinzipien der Thermodynamik wissen müssen.
Schlüsselmerkmale
Wenn wir eine Analyse der klassischen Thermodynamik durchführen, sehen wir, dass sie auf dem Konzept des makroskopischen Systems basiert. Dieses System ist nichts anderes als ein Teil der physischen oder konzeptuellen Masse, der von der äußeren Umgebung getrennt ist. Um thermodynamische Systeme besser untersuchen zu können, wird immer angenommen, dass es sich um eine physikalische Masse handelt, die durch den Energieaustausch mit dem externen Ökosystem nicht gestört wird.
Der Zustand eines makroskopischen Systems, was ist Unter Gleichgewichtsbedingungen wird es durch Größen spezifiziert, die als thermodynamische Variablen bezeichnet werden. Wir kennen alle diese Variablen und sie sind Temperatur, Druck, Volumen und chemische Zusammensetzung. All diese Variablen definieren die Systeme und ihr Gleichgewicht. Die wichtigsten Bezeichnungen für die chemische Thermodynamik wurden dank der angewandten internationalen Union festgelegt. Mit diesen Einheiten ist es möglich, das Gesetz der Thermodynamik zu arbeiten und besser zu erklären.
Es gibt jedoch einen Zweig der Thermodynamik, der das Gleichgewicht nicht untersucht, sondern für die Analyse thermodynamischer Prozesse verantwortlich ist, die hauptsächlich durch gekennzeichnet sind nicht in der Lage zu sein, Gleichgewichtsbedingungen auf stabile Weise zu erreichen.
Gesetze
Die Prinzipien wurden im XNUMX. Jahrhundert Isa diejenigen denunziert, die Sie sind dafür verantwortlich, alle Transformationen und ihren Fortschritt zu regulieren. Sie analysieren auch die tatsächlichen Grenzen, um eine echte Vorstellung zu haben. Sie sind Axiome, die nicht bewiesen werden können, aber erfahrungsgemäß nicht beweisbar sind. Jede Theorie der Thermodynamik basiert auf diesen Prinzipien. Wir können 3 Grundprinzipien plus das Prinzip unterscheiden, aber das ist dasjenige, das die Temperatur definiert und das in den anderen 3 Prinzipien impliziert ist.
Nullgesetz
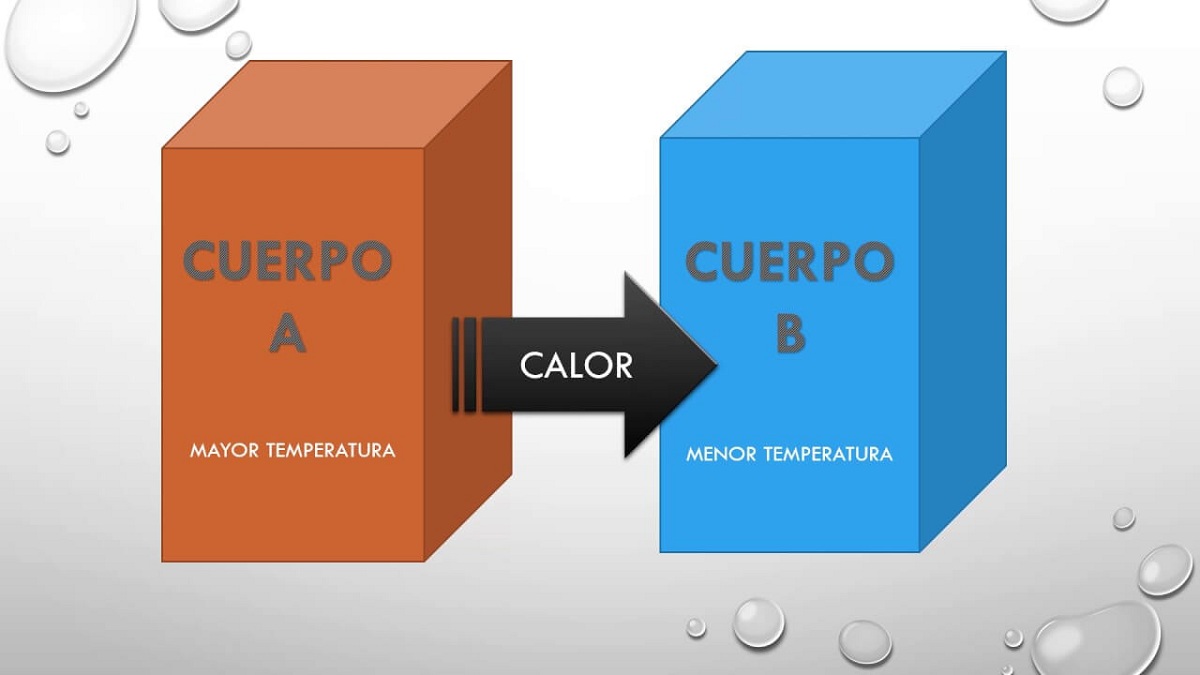
Wir werden beschreiben, was dieses Nullgesetz ist, das als erstes die Temperatur beschreibt, die in den übrigen Prinzipien impliziert ist. Wenn zwei Systeme miteinander interagieren und sich im thermischen Gleichgewicht befinden, teilen sie einige der Eigenschaften. Diese Eigenschaften, die sie miteinander teilen, können gemessen und mit einem numerischen Wert versehen werden. Wenn sich die beiden Systeme im Gleichgewicht mit einem dritten befinden, befinden sie sich im Gleichgewicht miteinander, und die gemeinsame Eigenschaft ist die Temperatur.
Daher besagt dieses Prinzip aber einfach, dass wenn Ein Körper A befand sich im Gleichgewicht mit einem Körper B und dieser Körper B befindet sich im thermischen Gleichgewicht mit einem Körper C, dann befinden sich auch die Körper A und C im Gleichgewicht Thermal. Dieses Prinzip erklärt die Tatsache, dass zwei Körper bei unterschiedlichen Temperaturen Wärme miteinander austauschen können. Früher oder später erreichen beide Körper die gleiche Temperatur, so dass sie sich im totalen Gleichgewicht befinden.
Erster Hauptsatz der Thermodynamik
Wenn ein Körper mit einem kälteren Körper in Kontakt gebracht wird, findet eine Transformation statt, die zu einem Gleichgewichtszustand führt. Dieser Gleichgewichtszustand beruht auf der Tatsache, dass die Temperatur der beiden Körper gleich ist, da eine Energieübertragung zwischen dem heißen Körper und dem kalten Körper verbessert wird. Um dieses Phänomen zu erklären, nahmen die Wissenschaftler an, dass eine heiße Substanz, die in größeren Mengen vorhanden ist, einen kälteren Körper passiert. Es wurde an eine Flüssigkeit gedacht, die sich durch die Masse bewegen konnte, um Wärme austauschen zu können.
Dieses Prinzip ist dafür verantwortlich, Wärme als Energieform zu identifizieren. Es ist keine materielle Substanz. Auf diese Weise konnte gezeigt werden, dass Wärme, gemessen in Kalorien und Arbeit, gemessen in Joule, gleichwertig sind. Deshalb wissen wir das heute 1 Kalorie entspricht ungefähr 4,186 Joule.
Man kann sagen, dass das erste Prinzip der Thermodynamik ein Prinzip der Energieerhaltung ist. Eine Energiemenge in einer Wärmekraftmaschine wird in Arbeit umgewandelt und kann von jeder Maschine gesehen werden, die solche Arbeit produzieren kann, ohne Energie zu verbrauchen. Wir können dieses erste Prinzip wie folgt festlegen: Die Variation der inneren Energie eines geschlossenen thermodynamischen Systems ist gleich der Differenz, die zwischen der dem System zugeführten Wärme und der von diesem System in der Umgebung geleisteten Arbeit besteht.
Zweiter Hauptsatz der Thermodynamik
Dies besagt zu Beginn, dass es unmöglich ist, eine zyklische Maschine herzustellen, die nur zur Übertragung von Wärme von einem kalten Körper auf einen warmen Körper führt. Wir können sagen, dass es unmöglich ist, eine Transformation durchzuführen, deren Ergebnis nur sein wird das Umwandeln der Wärme, die wir aus einer einzigen Quelle gewonnen haben, in mechanische Arbeit.
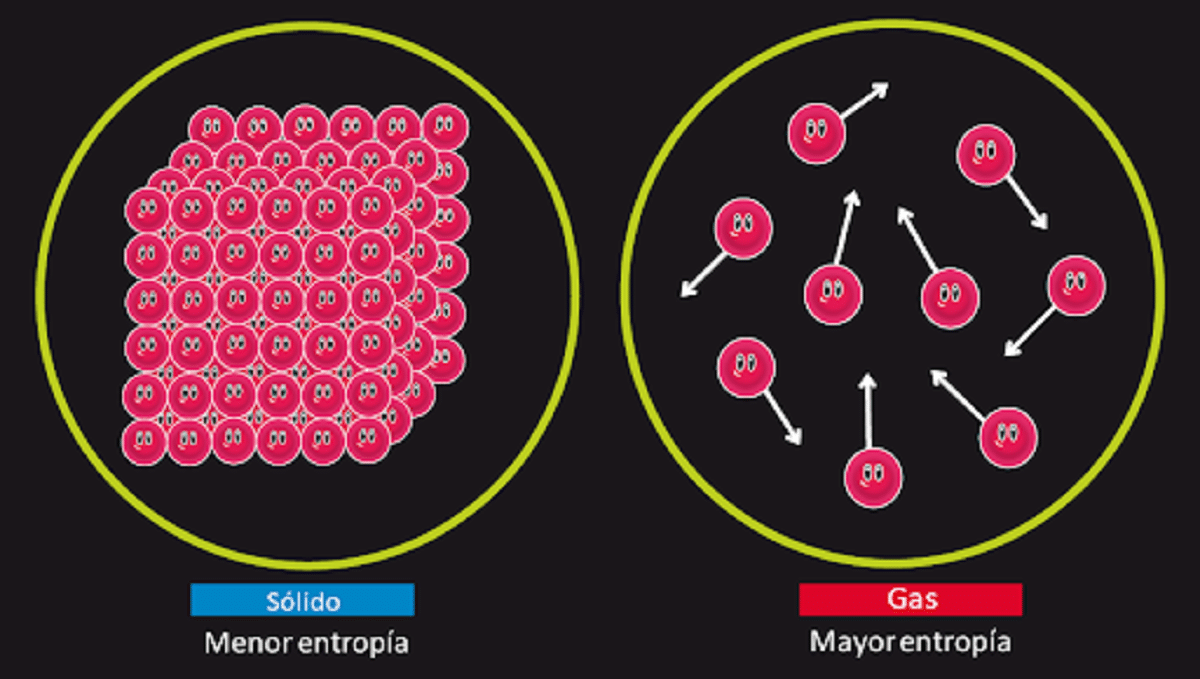
Dieses Prinzip ist dafür verantwortlich, die Möglichkeit zu leugnen, dass es die bekannte fortwährende Bewegung der zweiten Art gibt. Wir wissen, dass die Entropie eines Systems bleibt unverändert isoliert, wenn eine reversible Transformation stattfindet. Wir wissen auch, dass es zunimmt, wenn eine irreversible Transformation stattfindet.
Dritter Hauptsatz der Thermodynamik
Dieses letzte Prinzip ist eng mit dem zweiten verwandt und wird als Folge davon betrachtet. Dieses Prinzip bestätigt, dass absolutes Sein in Farbe mit einer endlichen Anzahl von Transformationen nicht erreicht werden kann. Wir wissen, dass es einen absoluten Nullpunkt gibt, der nicht höher ist als die Mindesttemperatur, die erreicht werden kann. In Einheiten Kelvin wir wissen, dass es 0 ist, aber in Grad Celsius hat es einen Wert von -273.15 Grad.
Es heißt auch, dass die Entropie für einen Feststoff, der mit einer Temperatur von 0 Kelvin perfekt kristallin ist, gleich 0 ist. Dies bedeutet, dass es keine Entropie geben würde, so dass das System völlig stabil wäre. Die Energie der Befreiung, Translation und Rotation der Teilchen, aus denen sie besteht, wäre bei einer Temperatur von 0 Kelvin nichts.
Ich hoffe, dass Sie mit diesen Informationen mehr über Thermodynamik und Grundprinzipien erfahren können.