
La Boyles Gesetz Es wurde im XNUMX. Jahrhundert von Robert Boyle entdeckt und legte den Grundstein, um die Beziehung zwischen Druck und Volumen in Gasen zu erklären. Durch eine Reihe von Experimenten gelang es ihm zu zeigen, dass ein Gas bei konstanter Temperatur sein Volumen verringert, wenn es einem höheren Druck ausgesetzt wird, und an Volumen zunimmt, wenn der Druck verringert wird.
In diesem Artikel erzählen wir Ihnen alles, was Sie über das Gesetz von Boyle, seine Eigenschaften und seine Bedeutung wissen müssen.
Schlüsselmerkmale
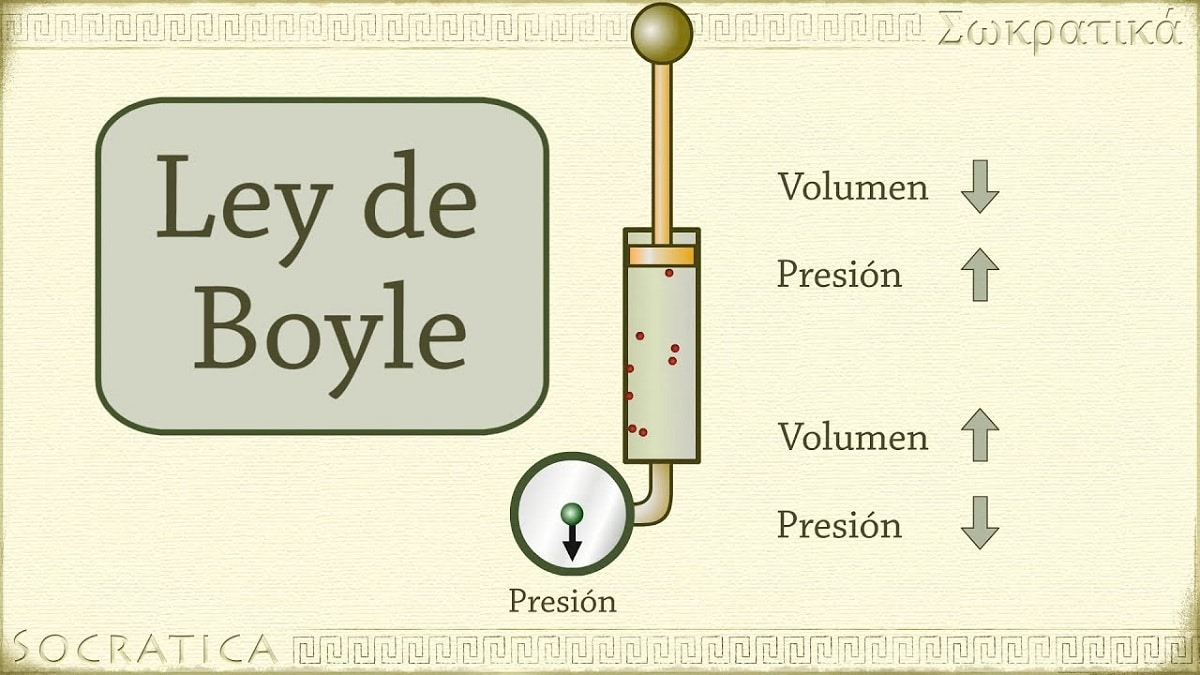
1662 entdeckte Robert Boyle, dass der auf ein Gas ausgeübte Druck bei konstanter Temperatur umgekehrt proportional zu seinem Volumen und seiner Molzahl ist. Mit anderen Worten, wenn der auf ein Gas ausgeübte Druck verdoppelt wird, dasselbe Gas wird komprimiert und sein Volumen wird halbiert.
Mit zunehmendem Volumen des das Gas enthaltenden Behälters nimmt auch die Strecke zu, die die Partikel zurücklegen müssen, bevor sie mit den Behälterwänden kollidieren. Durch diese Abstandsvergrößerung kann die Frequenz der Stöße abnehmen, sodass der Druck auf die Wand geringer ist als zuvor, als das Volumen kleiner war.
Das Gesetz von Boyle wurde erstmals 1662 von Robert Boyle entdeckt. Edme Mariotte war ein weiterer Wissenschaftler, der dachte und zu denselben Schlussfolgerungen kam wie BoyleAllerdings veröffentlichte Mariotte seine Arbeit erst 1676. Deshalb finden wir in vielen Büchern dieses Gesetz namens Boyle and Mariot's Law Boyle-Mariot's Law, auch bekannt als Mattut's Law, entwickelt von dem britischen Physiker und Chemiker Robert Es wurde formuliert unabhängig von Boyle und dem französischen Physiker und Botaniker Edmé Mattout.
Es bezieht sich auf eines der Gesetze, die das Volumen und den Druck eines Gases mit einer bestimmten Gasmenge in Beziehung setzen, die auf einer konstanten Temperatur gehalten wird. Das Gesetz von Boyle besagt Folgendes: Der von einer Kraft ausgeübte Druck ist physikalisch umgekehrt proportional zum Volumen einer gasförmigen Materie, solange ihre Temperatur konstant bleibt. Oder einfacher, wir können es interpretieren als: Bei einer höheren konstanten Temperatur ist das Volumen einer festen Gasmasse umgekehrt proportional zu dem konstanten Druck, den sie ausübt.
Experimente und Anwendungen des Boyleschen Gesetzes

Um die Theorie des Boyle-Gesetzes zu beweisen, war Mariot dafür verantwortlich, Gas in einen Zylinder mit einem Kolben einzuleiten, und konnte die unterschiedlichen Drücke überprüfen, die beim Absenken des Kolbens erzeugt wurden. Aus diesem Experiment wird gefolgert, dass der Druck abnimmt, wenn das Volumen zunimmt.
Das Gesetz von Boyle hat viele Anwendungen im modernen Leben, unter denen wir zum Beispiel das Tauchen erwähnen können, weil der Taucher beim Auftauchen die Luft aus seiner Lunge ausstoßen muss, weil sie sich ausdehnt, wenn der Druck abnimmt, andernfalls kann es zu Gewebeschäden kommen.
Es ist in allen Geräten zu finden, die pneumatische Energie verwenden oder von dieser angetrieben werden, wie z. B. Roboterarme, die Komponenten wie pneumatische Kolben, Aktuatoren, Druckregler und Druckentlastungsventile verwenden.
Benzin-, Gas- oder Dieselmotoren verwenden das Gesetz von Boyle auch während der Verbrennung, denn wenn Luft zum ersten Mal mit Volumen und Druck in den Zylinder eintritt, verringert sie beim zweiten Mal das Volumen durch zunehmenden Druck.
Autos haben Airbagsysteme, die funktionieren, indem sie eine bestimmte Menge Luft oder Gas aus einer Kammer ausstoßen, die den Außenairbag erreicht. wo der Druck abnimmt und das Volumen zunimmt, wobei eine konstante Temperatur beibehalten wird.
Das Gesetz von Boyle ist heute sehr wichtig, weil es das Gesetz ist, das zu uns spricht und das Verhalten von Gasen erklärt. Es erklärt definitiv, dass Druck und Volumen eines Gases umgekehrt proportional zueinander sind. Wenn also Druck auf ein Gas ausgeübt wird, nimmt sein Volumen ab und sein Druck steigt.
Ideales Gasmodell

Für sogenannte ideale Gase gilt das Boyle-Mariotte-Gesetz, ein theoretisches Modell, das das Verhalten jedes Gases stark vereinfacht, wenn man annimmt:
- Gasmoleküle Sie sind so klein, dass es nicht notwendig ist, über ihre Größe nachzudenken, insbesondere wenn man bedenkt, dass dies viel kleiner ist als die Entfernung, die sie zurücklegen.
- Zusätzlich die Moleküle interagieren kaum, außer wenn sie sehr kurz kollidieren, und wenn dies der Fall ist, ist die Kollision elastisch, sodass sowohl Impuls als auch kinetische Energie erhalten bleiben.
- Nehmen wir schließlich an, dass diese kinetische Energie proportional zur Temperatur der gasförmigen Probe ist, d.h. je stärker die Teilchen bewegt werden, desto höher ist die Temperatur.
Leichte Gase, unabhängig von ihrer Identität, befolgen diese Richtlinien sehr streng unter Standardbedingungen von Temperatur und Druck (dh: 0 ° C und Atmosphärendruck (1 Atmosphäre). Für diese Gase beschreibt das Boyle-Mariotte-Gesetz ihr Verhalten sehr genau. .
Da P∙V bei einer gegebenen Temperatur konstant ist, ändert sich das Volumen, wenn sich der Druck des Gases ändert, so dass das Produkt gleich bleibt, so dass in zwei verschiedenen Zuständen 1 und 2 die Gleichheit wie folgt ausgedrückt werden kann:
P1∙V1 = P2∙V2
Wenn Sie dann einen Zustand und eine Variable aus dem anderen Zustand kennen, können Sie die fehlende Variable kennen, indem Sie sie aus dem Boyle-Mariot-Gesetz entfernen.
Geschichte des Boyleschen Gesetzes
Britischer Chemiker. Pionier der Experimente auf dem Gebiet der Chemie, insbesondere der Eigenschaften von Gasen,
Die These von Robert Boyle über das Verhalten von Materie auf Teilchenebene war ein Vorläufer der modernen Theorie der chemischen Elemente. Er war auch Gründungsmitglied der Royal Society of London.
Robert Boyle wurde in Irland in eine Adelsfamilie hineingeboren und besuchte die besten englischen und europäischen Schulen. Von 1656 bis 1668 diente er als Assistent von Robert Hooke an der Universität Oxford und arbeitete mit ihm an einer Reihe von Experimenten zusammen, die die physikalischen Eigenschaften der Luft und ihre Verbrennung, Atmung und Schallübertragung bestimmten.
Die Ergebnisse dieser Beiträge wurden in ihrem gesammelt «Neue physikalisch-mechanische Experimente zur Luftelastizität und ihren Wirkungen» (1660). In der zweiten Auflage dieser Arbeit (1662) enthüllte er die berühmte Eigenschaft von Gasen, das Boyle-Mariotte-Gesetz, das besagt, dass das von einem Gas bei konstanter Temperatur eingenommene Volumen umgekehrt proportional zu seinem Druck ist. Heute weiß man, dass dieses Gesetz nur dann erfüllt ist, wenn man das theoretisch ideale Verhalten von Gasen akzeptiert.
Ich hoffe, dass Sie mit diesen Informationen mehr über das Gesetz von Boyle, seine Eigenschaften und Anwendungen in der Welt der Wissenschaft erfahren können.