
Sicher haben Sie das jemals gesehen Bohr-Atommodell. Dies ist eine ziemlich wichtige Entdeckung, die dieser Wissenschaftler für die Wissenschaft gemacht hat, insbesondere für Elektromagnetismus und Elektrochemie. Früher gab es das Rutherford-Modell, das ziemlich revolutionär und sehr erfolgreich war, aber es gab einige Konflikte mit anderen Atomgesetzen wie Maxwells und Newtons.
In diesem Artikel werden wir Ihnen alles erzählen, was Sie über Bohrs Atommodell wissen müssen, sowie seine Details, um Zweifel an diesem Thema zu klären.
Probleme, die es zu lösen half
Wie wir am Anfang des Artikels erwähnt haben, hat dieses Atommodell dazu beigetragen, bestimmte Konflikte zu lösen, die mit anderen Atomgesetzen bestanden. Im vorherigen Rutherford-Modell mussten wir Elektronen, die sich mit einer negativen elektrischen Ladung bewegten, mussten eine Art elektromagnetische Strahlung emittieren. Dies sollte aufgrund der Gesetze des Elektromagnetismus erfüllt werden. Dieser Energieverlust bewirkt, dass die Elektronen durch Spirale in Richtung Zentrum auf ihre Umlaufbahn reduziert werden. Als sie das Zentrum erreichten, brachen sie zusammen und kollidierten mit dem Kern.
Dies erzeugte theoretisch ein Problem, da es nicht mit dem Atomkern kollabieren konnte, sondern die Flugbahn der Elektronen unterschiedlich sein musste. Dies wurde mit dem Bohr-Atommodell gelöst. Das erklärt es Die Elektronen umkreisen den Kern in bestimmten Bahnen, die erlaubt sind und eine bestimmte Energie haben. Die Energie ist proportional zur Planckschen Konstante.
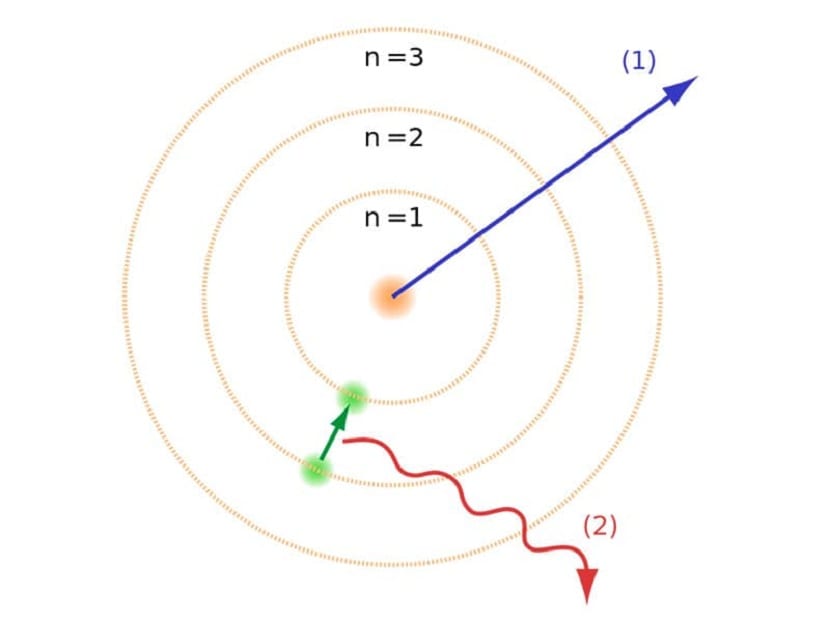
Diese Bahnen, die wir erwähnt haben, wo sich die Elektronen bewegen, wurden Energieschichten oder Energieniveaus genannt. Das heißt, die Energie, die Elektronen haben, ist nicht immer dieselbe, sondern wird quantisiert. Quantenniveaus sind die verschiedenen Bahnen, in denen sich Atome befinden. Je nachdem, in welcher Umlaufbahn es sich zu einem bestimmten Zeitpunkt befindet, wird es mehr oder weniger Energie haben. Die Bahnen, die näher am Atomkern liegen, haben eine größere Energiemenge. Andererseits, je mehr sie sich vom Kern entfernen, desto weniger Energie.
Modell des Energieniveaus
Dieses Bohr-Atommodell, das implizierte, dass Elektronen nur durch Springen von einer Umlaufbahn zur anderen Energie gewinnen oder verlieren konnten, trug zur Lösung des von Rutherfords Modell vorgeschlagenen Zusammenbruchs bei. Beim Übergang von einem Energieniveau zum anderen absorbiert oder emittiert es elektromagnetische Strahlung. Das heißt, wenn Sie von einem stärker geladenen zu einem weniger geladenen Energieniveau springen, setzen Sie die überschüssige Energie frei. Umgekehrt absorbiert es elektromagnetische Strahlung, wenn es von einem niedrigen zu einem höheren Energieniveau übergeht.
Da dieses Atommodell eine Modifikation des Rutherford-Modells ist, bleiben die Eigenschaften des kleinen zentralen Kerns und mit dem größten Teil der Masse des Atoms erhalten. Obwohl die Bahnen der Elektronen nicht flach sind wie die der Planeten, könnte man sagen, dass sich diese Elektronen ähnlich wie die Planeten um die Sonne um ihren Kern drehen.
Bohrs atomare Modellprinzipien

Wir werden nun die Prinzipien dieses Atommodells analysieren. Es geht um eine detaillierte Erläuterung des Modells und seiner Funktionsweise.
- Teilchen, die eine positive Ladung haben Sie sind im Vergleich zum Gesamtvolumen des Atoms in geringer Konzentration.
- Elektronen mit einer negativen elektrischen Ladung sind solche, die sich in kreisförmigen Energiebahnen um den Kern drehen.
- Es gibt Energieniveaus der Bahnen, durch die die Elektronen zirkulieren. Sie haben auch eine festgelegte Größe, sodass zwischen den Umlaufbahnen kein Zwischenzustand besteht. Sie gehen einfach von einer Ebene zur anderen.
- Die Energie, die jede Umlaufbahn besitzt, hängt von ihrer Größe ab. Je weiter die Umlaufbahn vom Atomkern entfernt ist, desto mehr Energie hat sie.
- Energieniveaus haben unterschiedliche Anzahlen von Elektronen. Je niedriger das Energieniveau, desto weniger Elektronen enthält es. Wenn wir uns zum Beispiel auf Stufe eins befinden, gibt es bis zu zwei Elektronen. Auf Stufe 2 können bis zu 8 Elektronen usw. vorhanden sein.
- Wenn sich Elektronen von einer Umlaufbahn zur anderen bewegen, absorbieren oder geben sie elektromagnetische Energie ab. Wenn Sie weniger von einer energetischen Ebene zu einer anderen wechseln, setzen Sie überschüssige Energie frei und umgekehrt.
Dieses Modell war revolutionär und versuchte, dem Material, das die Vorgängermodelle nicht hatten, Stabilität zu verleihen. Mit diesem Atommodell wurden auch die diskreten Emissions- und Absorptionsspektren der Gase erklärt. Es war das erste Modell, das das Konzept der Quantisierung oder Quantisierung einführte. Dies macht Bohrs Atommodell zu einem Modell, das auf halbem Weg zwischen klassischer Mechanik und Quantenmechanik liegt. Obwohl es auch Mängel aufweist, war es ein Vorläufermodell für die spätere Quantenmechanik von Schrödinger und anderen Wissenschaftlern.
Einschränkungen und Fehler des Bohr-Atommodells
Wie bereits erwähnt, weist dieses Modell auch bestimmte Mängel und Fehler auf. Erstens erklärt oder begründet es nicht, warum Elektronen nur auf bestimmte Umlaufbahnen beschränkt werden müssen. Es wird direkt angenommen, dass Elektronen einen bekannten Radius und eine bekannte Umlaufbahn haben. Dies ist jedoch nicht so. Ein Jahrzehnt später Heisenbergs Ungewissheitsprinzip widerlegte dies.
Obwohl dieses Atommodell das Verhalten von Elektronen in Wasserstoffatomen modellieren konnte, war es bei Elementen mit einer höheren Anzahl von Elektronen nicht so genau. Es ist ein Modell, das hat Probleme, den Zeeman-Effekt zu erklären. Dieser Effekt ist zu sehen, wenn die Spektrallinien bei Vorhandensein eines externen und statischen Magnetfelds in zwei oder mehr geteilt werden.
Ein weiterer Fehler und eine Einschränkung dieses Modells besteht darin, dass es einen falschen Wert für den Drehimpuls der Grundzustandsbahn liefert. All diese erwähnten Fehler und Einschränkungen führen dazu, dass Bohrs Atommodell Jahre später durch die Quantentheorie ersetzt wurde.
Ich hoffe, dass Sie mit diesem Artikel mehr über Bohrs Atommodell und seine Anwendungen in der Wissenschaft erfahren können.