
I videnskaben har der været mange forskere, der har gjort en forskel, når det kommer til at vide, hvordan ting fungerer. Viden om partikler, atomer og elektroner har givet mange fremskridt inden for videnskab. Derfor vil vi dedikere denne artikel til Thomsons atommodel. Det blev også kendt som Raisin Pudding-modellen.
I denne artikel kan du lære alt relateret til Thomsons atommodel, hvad dens egenskaber er, og hvor vigtigt det var for videnskaben.
Hvad er Thomson atommodel

Dette er en model, der blev udviklet i 1904, og den første subatomære partikel kan være blevet opdaget. Opdageren var den britiske videnskabsmand Joseph John Thomson. Denne mand var i stand til at opdage negativt ladede partikler gennem et eksperiment, hvor han brugte katodestrålerør i 1897.
Konsekvensen af denne opdagelse var ret enorm, da der ikke var noget bevis for, at atomet kunne have en kerne. Denne videnskabsmand får os til at tro, at elektronerne var nedsænket i en slags positivt ladet stof, der modvirker den negative ladning af elektronerne. Dette fik atomerne til at have den neutrale ladning.
At forklare dem på en måde, der forstås, er som at placere en gelé med rosiner, der flyder indeni. Deraf modelnavnet budding med rosiner. I denne model, Thomson var ansvarlig for at kalde elektronerne blodlegemer og mente, at de var arrangeret på en ikke-tilfældig måde. I dag er det kendt, at de er i en slags roterende ringe, og at hver ring har et andet energiniveau. Når en elektron mister energi, går den til et højere niveau, dvs. den bevæger sig væk fra atomets kerne.
Guldfolie eksperiment

Hvad Thompson mente var, at den positive del af atomet altid forblev på ubestemt tid. Denne model, som han oprettede i 1904, havde ikke bred akademisk accept. Fem år senere var Geiger og Marsden i stand til at udføre et eksperiment med en guldfolie, der gjorde Thomsons opdagelser mindre effektive. I dette eksperiment bestod de en stråle af helium alfapartikler gennem en guldfolie. Alfapartikler er intet andet end løver af et element, det vil sige kerner, der ikke har elektroner og derfor har en positiv ladning.
Resultatet af eksperimentet var, at denne stråle blev spredt, da den passerede gennem guldfolien. Med dette kunne det konkluderes, at der skulle være en kerne med en kilde til positiv ladning, der var ansvarlig for afbøjning af lysstrålen. På den anden side havde vi i Thomsons atommodel, at den positive ladning blev fordelt langs det, der blev sagt som gelatine, og som indeholdt elektronerne. Dette betyder, at en ionstråle kunne passere gennem atomen i den model.
Da det modsatte blev vist i det efterfølgende eksperiment, denne model kunne nægtes atomar.
Opdagelsen af elektronen kom også fra en del af en anden atommodel men fra Dalton. I denne model blev atom betragtet som helt udelelig. Dette fik Thomson til at tænke på sin Raisin Pudding-model.
Kendetegn ved Thomson-atommodellen
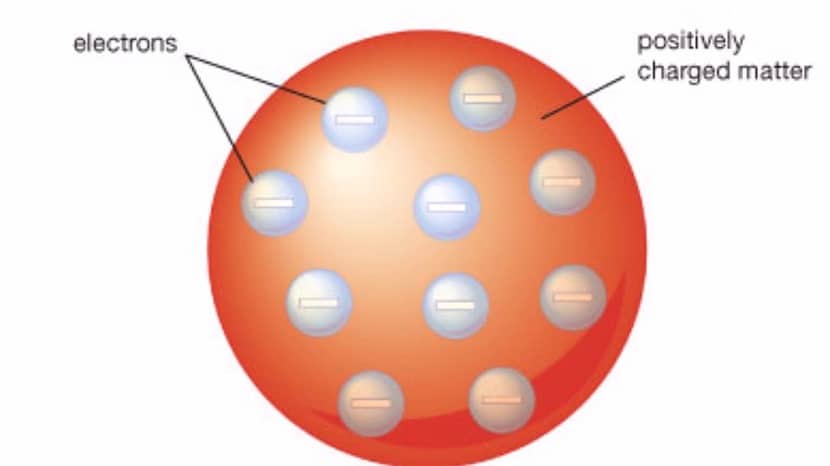
Blandt de vigtigste egenskaber ved denne model opsummerer vi følgende:
- Atomet, som denne model repræsenterer ligner en kugle, der har et positivt ladet materiale med elektroner der er negativt ladede. Både elektroner og positivt ladede stoffer er til stede inde i sfæren.
- De positive og negative ladninger har samme størrelse. Dette betyder, at atomet som helhed ikke har nogen ladning, men er elektrisk neutralt.
- Så at atomet generelt kan have en neutral ladning elektronerne skal nedsænkes i et stof, der har en positiv ladning. Det er hvad der nævnes med rosiner som en del af elektronerne, og resten af gelatinen er den del med en positiv ladning.
- Selvom det ikke forklares på en eksplicit måde, kan det udledes, at atomkernen i denne model ikke eksisterede.
Da Thomson skabte denne model, opgav han den tidligere hypotese om det nebulære atom. Denne hypotese var baseret på det faktum, at atomer bestod af immaterielle hvirvler. Som en dygtig videnskabsmand ønskede han at skabe sin egen atommodel baseret på de eksperimentelle beviser, der var kendt i hans tid.
På trods af at denne model ikke var helt nøjagtig, var den i stand til at hjælpe med etableringen af et fast fundament, så senere modeller kunne blive mere succesrige. Takket være denne model var det muligt at udføre forskellige eksperimenter, der førte til nye konklusioner, og sådan udviklede den videnskab, som vi kender i dag mere og mere.
Begrænsninger og fejl i Thomson-atommodellen
Vi skal analysere, hvilke spørgsmål de har, hvor denne model ikke lykkedes, og hvorfor den ikke kunne fortsætte. Den første ting er, at han ikke kunne forklare, hvordan ladningerne holdes på elektronerne inde i atomet. Da han ikke kunne forklare dette, kunne han heller ikke løse noget om et atoms stabilitet.
I sin teori nævnte han ikke noget om atomet, der besidder en kerne. Havde vi i dag vidst, at atomet består af kerne sammensat af protoner og neutroner og elektroner roterer rundt på forskellige energiniveauer.
Protoner og neutroner ville endnu ikke blive opdaget. Thompson forsøgte at basere sin model på en forklaring med de elementer, der var videnskabeligt bevist på det tidspunkt. Da guldfolieeksperimentet blev bekræftet, blev det hurtigt kasseret. I dette eksperiment blev det vist, at der skal være noget inde i atomet, der får det til at have en positiv ladning og en større masse. Dette er allerede kendt for at være atomens kerne.
Jeg håber, at du med disse oplysninger kan lære mere om Thomsons atommodel.