Gruppen hydroxyl Det er det der består af et oxygenatom og et hydrogenatom og ligner et vandmolekyle. Det kan findes i forskellige kemiske former, såsom i en gruppe, en ion eller en gruppe. For alle de mennesker, der studerer organisk kemi, er det vigtigt at kende reaktionerne og vigtigheden af denne gruppe af atomer. Og det er i stand til at danne essentielle bindinger med kulstofatomet, skønt det også kan gøre det med svovl og fosfor.
I denne artikel vil vi fortælle dig om hydroxylgruppens egenskaber og den betydning, den har i organisk kemi.
Vigtigste funktioner
Når vi analyserer hydroxylgruppen set fra uorganisk kemi, ser vi, at den deltager mere som en ion. Det vil sige, at den type blonder, der findes mellem den og metallerne, ikke er kovalent, men ionisk. På grund af dette er hydroxylgruppen blevet et vigtigt element, der hjælper med at definere egenskaberne og transformationerne af mange forbindelser.
Hydroxylgruppen er bundet til en gruppe, der er defineret cmed bogstavet R, hvis det er alkyl, eller med bogstavet Ar, hvis det er aromatisk. Det jeg ved mest om videnskab er, hvad der bidrager med hydroxylgruppen til det molekyle, hvori det binder. Det bedste svar findes i undersøgelsen af dets protoner. Og det er, at protoner kan fjernes med stærke baser for at kunne danne salte. Dette kan også interagere med andre omgivende grupper, der er forbundet med hinanden ved hjælp af hydrogenbindinger. Derudover er det vigtigste ved hydroxylgruppen, at den, uanset hvor den er, kan repræsentere et potentielt område for dannelse af vand.
Struktur af hydroxylgruppen

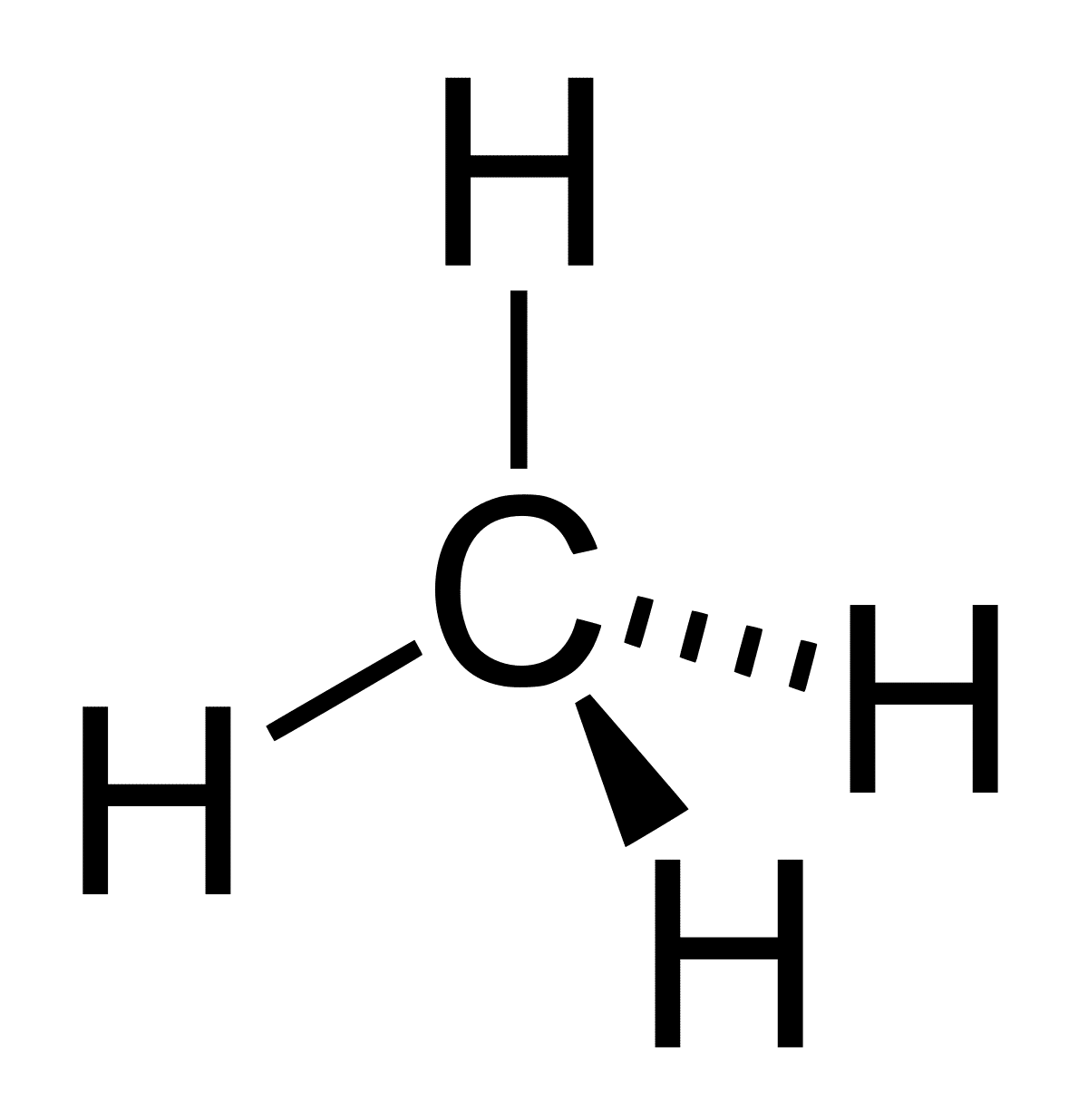
Hydroxylgruppen er blevet et ganske interessant molekyle set fra den organiske kemis synspunkt. Vandmolekylet er kantet i form og ligner en boomerang. Hvis vi klipper en af dens ender, hvilket betyder det samme som at fjerne en proton, forskellige situationer kan opstå. Vandmolekylet er transformeret til hydroxylgruppen eller hydroxylionen. Begge har dog en lineær molekylgeometri og er ikke elektroniske.
Alle disse obligationer skyldes det faktum, at de er orienteret mod to atomer for at være i stand til at være på linie til enhver tid. Det samme er ikke tilfældet med hybridorbitaler. Nøglen til hydroxylgruppen, så de forskellige molekyler kan blandes med hinanden har brug for hydrogenbindinger. Disse hydrogenbindinger er ikke stærke i sig selv, men efterhånden som antallet af kilder øges, og antallet af hydroxylgrupper i en struktur øges, multipliceres virkningerne. Denne stigning i antallet af hydrogenbindinger afspejles også i forbindelsens fysiske egenskaber.
Hydrogenbindinger kræver atomerne er placeret overfor hinanden. Der er nogle iltatomer i en hydroxylgruppe, der skal arrangeres på en sådan måde, at den kan generere en lige linje med hydrogenet fra en anden gruppe. Dette er noget mere komplekst, men det sker ofte. På denne måde stammer helt specifikke rumlige arrangementer som f.eks hvad der sker inden for strukturen af DNA-molekylet. Dette sker mellem de nitrogenholdige baser, der udgør DNA.
Vi kan kalde antallet af hydroxylgrupper for en struktur, der er direkte proportional med vandets affinitet for molekylet. Vi vil give et eksempel for at forstå det bedre. Sukker, selvom det har en hydrofob kulstofstruktur, da det har et stort antal hydroxylgrupper, gør det meget opløseligt i vand.
Ioner og deres funktioner
Hydroxylgruppen og ionen er meget ens, men har forskellige kemiske egenskaber. Hydroxylionen er en ekstremt stærk base og fungerer ved at fange protoner. Hvis vi tvinger det, kan det blive til vand. Og dette er et ufuldstændigt vandmolekyle, der er negativt ladet og har brug for en proton for at fuldføre. På den anden side, da hydroxylgruppen det behøver ikke at fange protoner for at fuldføre det opfører sig som en ekstremt svag base. Det er i stand til at donere protoner, selvom det kun gør det mod baser, der er meget stærke.
Positive kerner er atomer i et molekyle, der lider af en elektronisk mangel som et resultat af deres elektronegative miljø.
Hydroxylgruppe og meteorologi

Vi ved, at det fungerer som en type vaskemiddel i luften, der nedbryder andre gasser. Vi ved, at hydroxylgruppen er den vigtigste kontrol af metankoncentrationen. Metangas er en drivhusgas, der kun overskrides i koncentration af kuldioxid i dets bidrag til global opvarmning. Selvom metangas findes i mindre grad i atmosfæren, er den i stand til at tilbageholde en større mængde varme end kuldioxid.
Der er ny forskning ledet af en NASA-postdoktor, der har vist, at hydroxylradikaler genbruger sig selv og er i stand til at opretholde en konstant atmosfærisk koncentration. Denne koncentration opretholdes over tid, selvom metanemissionerne stiger. Derfor er det vigtigt at forstå hydroxyls rolle for at forstå metanens og atmosfærens levetid.
Forskere har påpeget, at stigende koncentrationer og emissioner af metangas kan medføre, at mængden af hydroxylradikaler tømmes globalt. På denne måde ville metanens levetid blive forlænget, et problem, der ville øge den globale opvarmning. Ved at gøre metanens levetid længere, ville vi ikke have noget at rense atmosfæren med. De primære kilder til hydroxyl og methan, og hvordan de reagerer, er blevet observeret. Genanvendelse af denne gruppe sker efter nedbrydning af metan og derefter reformeres i nærværelse af andre gasser. Hydroxylkoncentrationer er ret stabile over tid. De bør ikke nødvendigvis forsvinde, når det reagerer med metan.
Jeg håber, at du med disse oplysninger kan lære mere om hydroxylgruppen og al dens betydning.