
Po známosti Thomsonův atomový model, který považoval elektrony za kladně nabité médium, pokročilejší model známý jako Rutherfordův atomový model. Vědec odpovědný za tento nový pokrok ve vědě byl Ernest Rutherford. Narodil se 20. srpna 1871 a zemřel 19. října 1937. Během svého života významně přispěl k chemii a světu vědy obecně.
Proto se budeme věnovat tomuto článku, abychom vám řekli vše, co potřebujete vědět o atomovém modelu Rutherforda.
Experiment se zlatými listy
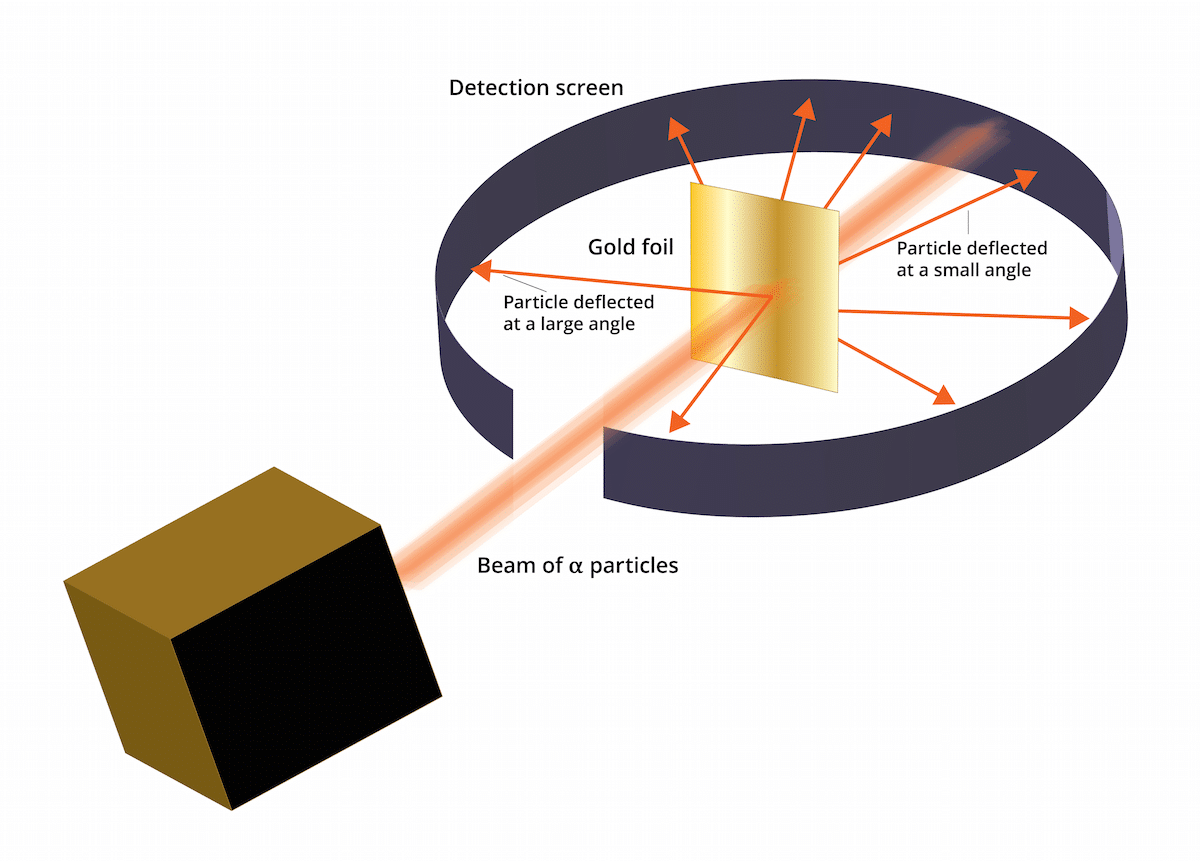
Starý thomsonův model řekl, že elektrony byly v kladně nabitém médiu. V roce 1909 provedl Ernest Rutherford v doprovodu dvou asistentů jménem Geiger a Marsden studii známou jako experiment Zlatý list, kde byli schopni ověřit, že Thomsonův známý „pudink s rozinkami“ se mýlil. A je to, že tento nový experiment dokázal ukázat, že atom měl strukturu se silným kladným nábojem. Tento experiment by mohl pomoci obnovit některé závěry, které byly v roce 1911 prezentovány jako Rutherfordův atomový model.
Experiment známý jako Leaf of Gold nebyl ojedinělý, ale byl proveden v letech 1909 až 1913. K tomu využili fyzikální laboratoře univerzity v Manchesteru. Tyto experimenty měly velký význam, protože z jejich výsledků bylo možné vyvodit nové závěry, které vedly k revolučnímu atomovému modelu.
Tento experiment sestával z následujícího: tenká vrstva zlata o tloušťce pouhých 100 nm musela být bombardována velkým množstvím alfa částic. Tyto alfa částice byly a ionty. To znamená, že atomy, které nemají elektrony, měly tedy pouze protony a neutrony. Díky neutronům a protonům byl celkový náboj atomu kladný. Tento experiment měl hlavně za cíl potvrdit, zda je Thomsonův model správný. Pokud měl tento model pravdu, částice alfa musely procházet atomy zlata v přímce.
Aby bylo možné studovat vychýlení způsobené alfa částicemi, musel být kolem fólie z jemného zlata umístěn fluorescenční filtr na bázi sulfidu zinečnatého. Výsledkem tohoto experimentu je, že bylo možné pozorovat, že některé částice byly schopny procházet atomy zlata listu v přímce. Některé z těchto alfa částic však byly odkloněny v náhodných směrech.
Závěry experimentu se zlatými listy

Vzhledem k této skutečnosti nebylo možné potvrdit, co se považuje za předchozí atomové modely. A je to tak, že tyto atomové modely poukazovaly na to, že kladný náboj byl v atomech distribuován rovnoměrně, což by usnadnilo jeho překročení, protože jeho náboj by v určitém okamžiku nebyl tak silný.
Výsledky tohoto experimentu se zlatými listy byly naprosto neočekávané. Toto přimělo Rutherforda, aby si myslel, že atom má střed se silným kladným nábojem, který vznikl, když byla alfa částice zkuste to rozdat odmítnuto centrální strukturou. Za účelem získání spolehlivějšího zdroje byly částice brány v úvahu v množstvích těch, které se odrážely, a těch, které nebyly. Díky tomuto výběru částic bylo možné určit velikost jádra ve srovnání s oběžnou dráhou elektronů, které jsou kolem něj. Lze také dojít k závěru, že většina prostoru atomu je prázdná.
Bylo vidět, že některé alfa částice byly vychýleny zlatou fólií. Někteří se odchýlili jen pod velmi malými úhly. To pomohlo k závěru, že kladný náboj na atomu není rovnoměrně rozložen. To znamená, že kladný náboj je umístěn na atomu koncentrovaným způsobem ve velmi malém objemu prostoru.
Velmi málo alfa částic se vznášelo zpět. Tato odchylka naznačuje, že by se částice mohly odrazit. Díky všem těmto novým úvahám mohl být Rutherfordův atomový model vytvořen s novými nápady.
Rutherfordův atomový model

Budeme studovat, jaké jsou principy Rutherfordova atomového modelu:
- Částice, které mají uvnitř atomu kladný náboj jsou uspořádány ve velmi malém objemu, pokud to porovnáme s celkovým objemem uvedeného atomu.
- Téměř veškerá hmota, kterou atom má, je v uvedeném malém objemu. Tato vnitřní hmota se nazývala jádro.
- Elektrony, které mají záporné náboje se nacházejí rotující kolem jádra.
- Elektrony se otáčejí vysokou rychlostí, když jsou kolem jádra, a to v kruhových drahách. Tyto trajektorie se nazývaly oběžné dráhy. Později budu oni jsou známí jako orbitals.
- Oba ty elektrony, které byly záporně nabité, a samotné jádro kladně nabitého atomu jsou vždy drženy pohromadě díky elektrostatické přitažlivé síle.
Přijetí a omezení Rutherfordova atomového modelu
Jak se dalo očekávat, tento nový model představil zcela nové panorama atomu ve vědeckém světě. Díky tomuto atomovému modelu mohlo mnoho pozdějších vědců studovat a určit počet elektronů, které má každý prvek v periodické tabulce. Kromě toho by mohly být učiněny nové objevy, které pomohou vysvětlit fungování atomu nejjednodušším způsobem.
Tento model má však také některá omezení a chyby. Ačkoli to byl průlom ve světě fyziky, nebyly ani dokonalým, ani úplným modelem. A je to z podle Newtonových zákonů a důležitého aspektu Maxwellových zákonů, tento model nemohl vysvětlit určité věci:
- Nedokázal vysvětlit, jak jsou záporné náboje schopné držet pohromadě v jádru. Podle elektronické holenní kosti se kladné náboje musí navzájem odpuzovat.
- Další rozpor byl vůči základním zákonům elektrodynamiky. Pokud se má za to, že elektrony s kladným nábojem rotují kolem jádra, měly by vyzařovat elektromagnetické záření. Při emitování tohoto záření se spotřebovává energie na to, aby se elektrony zhroutily v jádru. Proto pruhovaný atomový model nemůže vysvětlit stabilitu atomu.
Doufám, že s těmito informacemi se dozvíte více o Rutherfordově atomovém modelu.