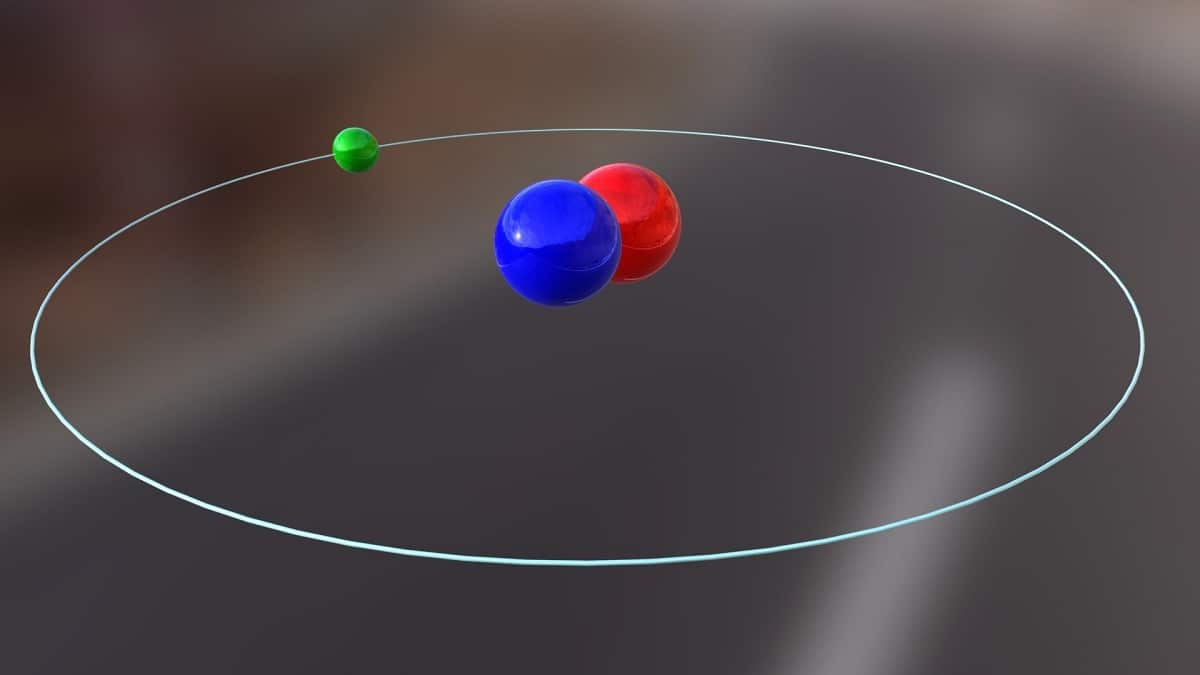
Dnes budeme hovořit o izotopu, který se používá k výrobě jaderné energie. Je to o deuterium. Je to jeden z izotopových druhů vodíku a je reprezentován symbolem D nebo 2H. Dostal obecný název těžký vodík, protože hmotnost je dvakrát větší než hmotnost protonu. Izotop není nic jiného než druh, který pochází ze stejného chemického prvku, ale má jiné hmotnostní číslo. Deuterium se používá k různým účelům.
Z tohoto důvodu se budeme věnovat tomuto článku, abychom vám řekli všechny vlastnosti, strukturu, vlastnosti a použití deuteria.
Hlavní charakteristiky
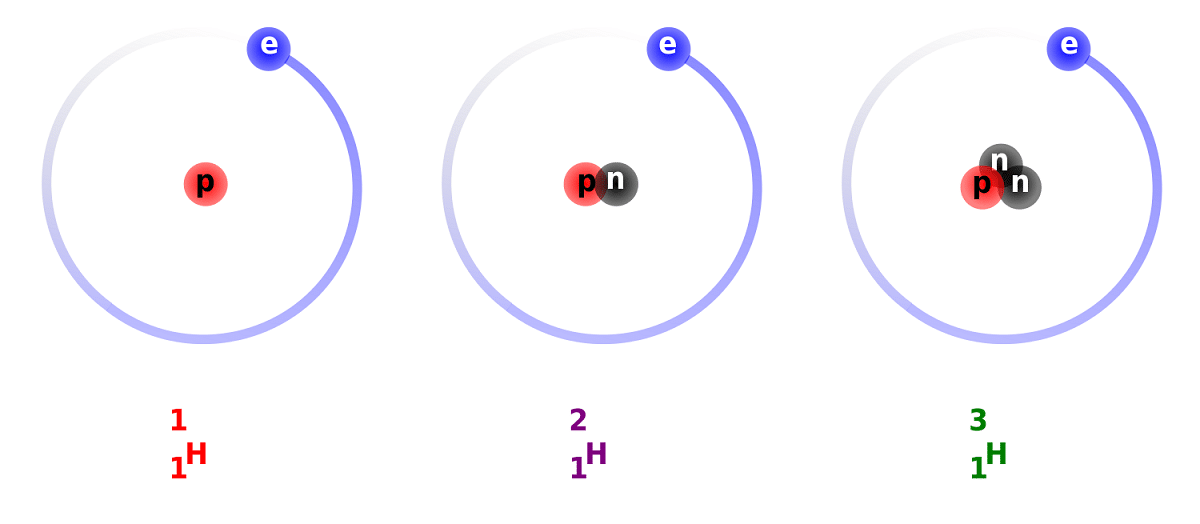
Rozdíl mezi deuteriem a vodíkem je způsoben rozdílem v počtu neutronů, které má. Z tohoto důvodu je deuterium považováno za stabilní izotop a lze jej nalézt ve sloučeninách tvořených vodíkem zcela přírodního původu. Je třeba vzít v úvahu, že i když jsou přírodního původu, vyskytují se v malé míře. Vzhledem k jeho vlastnostem je tak podobný běžnému vodíku, jej může nahradit celý v reakcích, kterých se účastní. Tímto způsobem jej lze převést na ekvivalentní látky.
Z tohoto a dalších důvodů má deuterium velké množství aplikací v různých oblastech vědy. V průběhu let se stal jedním z nejdůležitějších prvků výzkumu a pokroku v oblasti technologií a informací.
Hlavní strukturu tohoto izotopu tvoří jádro, které má proton a neutron. Má atomovou hmotnost přibližně 2,014 XNUMX gramů. Tento izotop byl objeven díky chemikovi Harolda C. Ureye ze Spojených států a jeho spolupracovníkům Ferdinandu Brickweddeovi a Georgovi Murphymu v roce 1931. Příprava setkání s deuteriem v čistém stavu byla úspěšně provedena poprvé v roce 1933. Je to již v padesátých letech minulého století, kdy se začala používat pevná fáze, která vykazovala velkou stabilitu, známá jako deuterid lithný. Tato látka by mohla nahradit deuterium a tritium při velkém počtu chemických reakcí.
Vědecký pokrok nastává, když je nalezena látka, která může usnadnit chemické reakce při výrobě produktů. V tomto smyslu, pokud jste studovali hojnost tohoto izotopu, abyste byli schopni pozorovat určité věci. Je známo, že podíl deuteria ve vodě se mírně liší v závislosti na oblasti, kde byl vzorek odebrán. Existuje několik studií spektroskopie určili existenci tohoto izotopu na jiných planetách v naší galaxii. To může mít velký význam pro studium složení jiných nebeských těles.
Struktura a původ deuteria

Budeme znát některá fakta o deuteriu. Jak jsme již zmínili, hlavní rozdíl mezi izotopy vodíku spočívá v jejich struktuře. Je to tak, že vodík, deuterium a tritium mají různá množství protonů a neutronů, takže mají různé chemické vlastnosti. Musím také mít na paměti, že deuterium, které existuje uvnitř jiných hvězdných těl, je eliminováno větší rychlostí, než bylo vytvořeno. To je jeden z důvodů, proč je tak obtížné studovat přítomnost deuteria ve hvězdných tělesech.
O jiných přírodních jevech se uvažuje, že tvoří nepatrné množství deuteria, takže jeho výroba dnes stále vyvolává značný zájem. Z procenta, které jsme již zmínili o přítomnosti deuteria v přírodě, to není 0.02%. Řada vědeckých výzkumů odhalila, že drtivá většina atomů, které byly vytvořeny z deuteria, přirozeně pocházela z exploze, která vedla ke vzniku vesmíru známého jako Velký třesk. To je jeden z hlavních důvodů, proč se předpokládá, že deuterium je přítomno na velkých planetách, jako je Jupiter.
Nejběžnějším způsobem, jak získat tento izotop přirozeně, je kombinace s vodíkem. Když k tomu dojde, bude to kombinováno v protiové formě. Vědci se zajímají o to, jaký vztah existuje mezi podílem deuterium a vodík v různých oblastech vědy. Je široce studován v oborech vědy, jako je astronomie nebo klimatologie. V těchto odvětvích má několik praktických nástrojů pro poznání a porozumění vesmíru a naší atmosféře.
Vlastnosti deuteria

Budeme vědět, jaké jsou hlavní vlastnosti, které má tento izotop patřící k vodíku. Nejprve je třeba vědět, co je to izotop bez radioaktivních vlastností. To znamená, že je v přírodě celkem stabilní. Může být použit k nahrazení vodíku v různých chemických reakcích. Tím, že má přirozeně velkou stabilitu, vykazuje odlišné chování od běžného vodíku. To se děje u všech reakcí, které mají biochemickou povahu. Před nahrazením je nutné vědět, že ačkoliv toho lze dosáhnout výměnou vodíku za deuterium v chemických reakcích, je třeba vědět, že se budou chovat odlišně.
Když jsou dva vodíkové atomy ve vodě nahrazeny, lze získat sloučeninu známou jako těžká voda. Vodík, který je přítomen v oceánu a je ve formě deuteria má pouze podíl 0,016% ve vztahu k protiu. Ve vesmíru má tento izotop tendenci rychleji se spojovat, aby vznikl hélium. Pokud zkombinujeme deuterium s atomovým kyslíkem, zjistíme, že se z něj stává toxický druh. Navzdory tomu, a chemické vlastnosti nebo velmi podobné jako u vodíku.
Další z vlastností tohoto izotopu je, že když jsou atomy deuteria vystaveny procesu jaderné fúze při vysokých teplotách, může se uvolnit velké množství energie. Je to exodus, který jste studovali, abyste dokázali implantovat jadernou fúzi naší planety. Některé fyzikální vlastnosti, jako je bod varu, výparné teplo, trojný bod a hustota mají veličiny větší než vodík.
Doufám, že s těmito informacemi se dozvíte více o deuteriu a jeho vlastnostech.