
La Boyleův zákon objevil ho Robert Boyle v XNUMX. století a položil základy k vysvětlení vztahu mezi tlakem a objemem přítomným v plynech. Prostřednictvím řady experimentů se mu podařilo ukázat, že pokud je teplota konstantní, plyn zmenšuje svůj objem, když je vystaven většímu tlaku, a zvětšuje svůj objem, pokud je tlak snížen.
V tomto článku vám řekneme vše, co potřebujete vědět o Boylově zákoně, jeho vlastnostech a důležitosti.
Hlavní charakteristiky
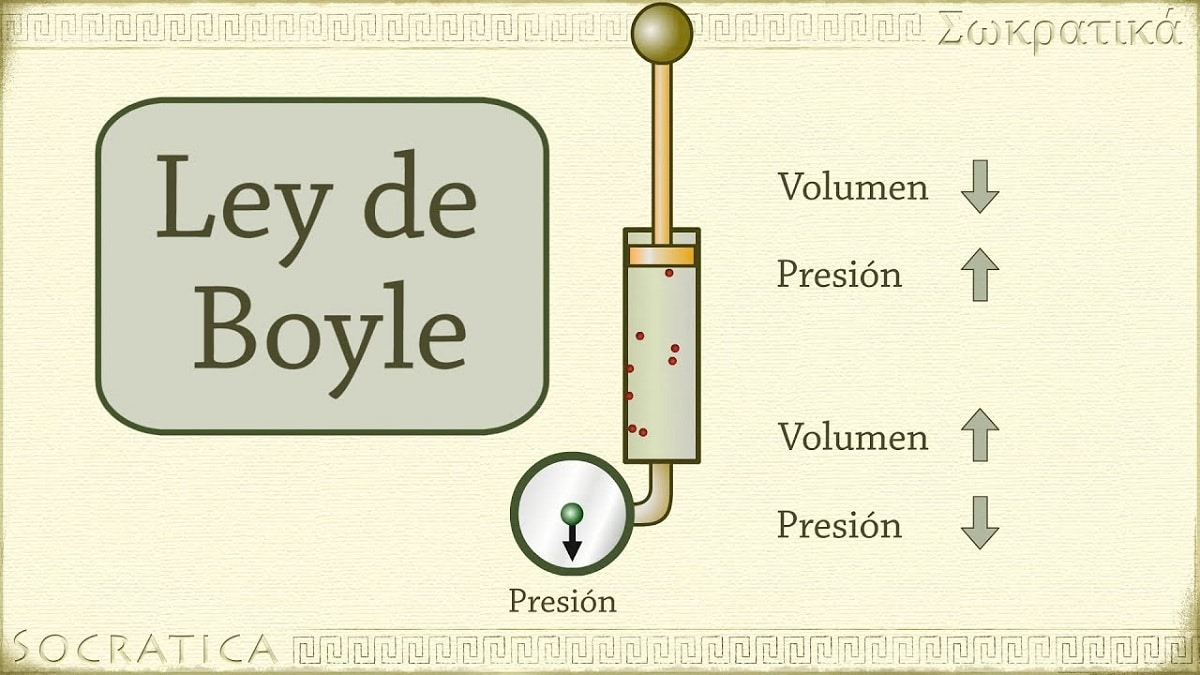
V roce 1662 Robert Boyle objevil, že tlak vyvíjený na plyn je nepřímo úměrný jeho objemu a počtu molů při konstantní teplotě. Jinými slovy, pokud se tlak aplikovaný na plyn zdvojnásobí, stejný plyn se stlačí a jeho objem se zmenší na polovinu.
S rostoucím objemem nádoby obsahující plyn se také zvyšuje vzdálenost, kterou musí částice urazit, než se střetnou se stěnami nádoby. Toto zvětšení vzdálenosti umožňuje snížit frekvenci otřesů, takže tlak na stěnu je menší než dříve, když byl objem menší.
Boyleův zákon poprvé objevil v roce 1662 Robert Boyle. Edme Mariotte byl dalším vědcem, který uvažoval a došel ke stejným závěrům jako BoyleMariotte však své dílo zveřejnil až v roce 1676. Proto v mnoha knihách najdeme tento zákon nazvaný Boyleův a Mariotův zákon Boyle-Mariotův zákon, známý také jako Mattutův zákon, vyvinutý britským fyzikem a chemikem Robertem Byl formulován nezávisle Boyle a francouzský fyzik a botanik Edmé Mattout.
Odkazuje na jeden ze zákonů, které vztahují objem a tlak plynu k určitému množství plynu udržovaného na konstantní teplotě. Boyleův zákon říká následující: Tlak vyvíjený silou je fyzikálně nepřímo úměrný objemu plynné hmoty, pokud její teplota zůstává konstantní. Nebo jednodušeji, můžeme to interpretovat jako: při vyšší konstantní teplotě je objem pevné hmoty plynu nepřímo úměrný konstantnímu tlaku, který vyvíjí.
Experimenty a aplikace Boyleova zákona

Aby dokázal teorii Boyleova zákona, měl Mariot na starosti zavádění plynu do válce s pístem a byl schopen ověřit různé tlaky, které vznikaly při sestupu pístu. Z tohoto experimentu lze usuzovat, že s rostoucím objemem klesá tlak.
Boylův zákon má v moderním životě mnoho aplikací, mezi kterými můžeme zmínit například potápění, je to proto, že potápěč musí při výstupu vzduch z plic vytlačit, protože se při poklesu tlaku rozpíná, pokud tak neučiní, může dojít k poškození tkáně.
Nachází se ve všech zařízeních, která využívají nebo jsou poháněna pneumatickou energií, jako jsou robotická ramena, která používají součásti, jako jsou pneumatické písty, akční členy, regulátory tlaku a přetlakové ventily.
Benzínové, plynové nebo vznětové motory využívají při vnitřním spalování také Boylův zákon, protože poprvé vstupuje vzduch do válce s objemem a tlakem, podruhé objem zmenšuje zvýšením tlaku.
Auta mají systémy airbagů, které fungují tak, že vytlačují určité množství vzduchu nebo plynu z komory, která dosáhne vnějšího airbagu, kde tlak klesá a objem se zvětšuje při zachování konstantní teploty.
Boylův zákon je dnes velmi důležitý, protože je to zákon, který k nám promlouvá a vysvětluje chování plynů. Rozhodně to vysvětluje, že tlak a objem plynu jsou navzájem nepřímo úměrné. Proto, když je na plyn aplikován tlak, jeho objem se zmenšuje a jeho tlak se zvyšuje.
ideální model plynu

Boyle-Mariotteův zákon platí pro takzvané ideální plyny, teoretický model, který značně zjednodušuje chování jakéhokoli plynu, za předpokladu:
- molekul plynu jsou tak malé, že není nutné přemýšlet o jejich velikosti, zvláště vezmeme-li v úvahu, že je to mnohem menší než vzdálenost, kterou urazí.
- Navíc, molekuly sotva interagují, kromě případů, kdy se srazí velmi krátce, a když se tak stane, srážka je elastická, takže hybnost i kinetická energie jsou zachovány.
- Nakonec předpokládejme, že tato kinetická energie je úměrná teplotě plynného vzorku, tj. čím více jsou částice rozrušené, tím vyšší je teplota.
Lehké plyny, bez ohledu na jejich identitu, dodržují tyto směrnice velmi přísně za standardních podmínek teploty a tlaku (tj.: 0ºC a atmosférický tlak (1 atmosféra). Pro tyto plyny velmi přesně popisuje jejich chování Boyle-Mariotteův zákon. .
Protože P∙V je při dané teplotě konstantní, změní se při změně tlaku plynu objem tak, že součin zůstane stejný, takže ve dvou různých stavech 1 a 2 lze rovnost vyjádřit následovně:
P1∙V1 = P2∙V2
Když pak znáte jeden stav plus proměnnou z druhého stavu, můžete chybějící proměnnou znát tak, že ji odstraníte z Boyle-Mariotova zákona.
Historie Boyleova zákona
Britský chemik. Průkopník experimentů v oblasti chemie, zejména vlastností plynů,
Teze Roberta Boylea o chování hmoty na úrovni částic byla předchůdcem moderní teorie chemických prvků. Byl také zakládajícím členem Královské společnosti v Londýně.
Robert Boyle se narodil do šlechtické rodiny v Irsku a navštěvoval nejlepší anglické a evropské školy. V letech 1656 až 1668 sloužil jako asistent Roberta Hooka na Oxfordské univerzitě a spolupracoval s ním na řadě experimentů, které určovaly fyzikální vlastnosti vzduchu a jak hoří, dýchá a přenáší zvuk.
Výsledky těchto příspěvků byly shromážděny v jejich „Nové fyzikálně-mechanické pokusy o pružnosti vzduchu a jeho účincích» (1660). Ve druhém vydání tohoto díla (1662) odhalil slavnou vlastnost plynů, Boyle-Mariotteův zákon, který říkal, že objem zabraný plynem při konstantní teplotě je nepřímo úměrný jeho tlaku. Dnes je známo, že tento zákon je naplněn pouze tehdy, je-li akceptováno teoretické ideální chování plynů.
Doufám, že s těmito informacemi se dozvíte více o Boylově zákoně, jeho charakteristikách a aplikacích ve světě vědy.