
Už jste někdy viděli Bohrův atomový model. Jedná se o docela důležitý objev, který tento vědec provedl pro vědu, zejména pro elektromagnetismus a elektrochemii. Dříve existoval Rutherfordův model, který byl docela revoluční a velmi úspěšný, ale došlo k určitým konfliktům s jinými atomovými zákony, jako jsou Maxwellovy a Newtonovy.
V tomto článku vám řekneme vše, co potřebujete vědět o Bohrově atomovém modelu, stejně jako jeho podrobnosti k objasnění veškerých pochybností o tomto tématu.
Problémy, které to pomohlo vyřešit
Jak jsme zmínili na začátku článku, tento atomový model pomohl vyřešit určité konflikty, které existovaly s jinými atomovými zákony. V předchozím modelu Rutherford jsme museli elektrony pohybující se se záporným elektrickým nábojem musely vyzařovat určitý druh elektromagnetického záření. To by mělo být splněno kvůli zákonům elektromagnetismu tam venku. Tato ztráta energie způsobí, že elektrony budou redukovány na svou oběžnou dráhu pohybující se ve spirále směrem ke středu. Když dorazili do středu, zhroutili se a narazili do jádra.
To teoreticky způsobilo problém, protože se nemohlo zhroutit s jádrem atomů, ale trajektorie elektronů musela být odlišná. To bylo vyřešeno Bohrovým atomovým modelem. Vysvětluje to elektrony obíhají kolem jádra na určitých drahách, které jsou povoleny a které mají specifickou energii. Energie je úměrná Planckově konstantě.
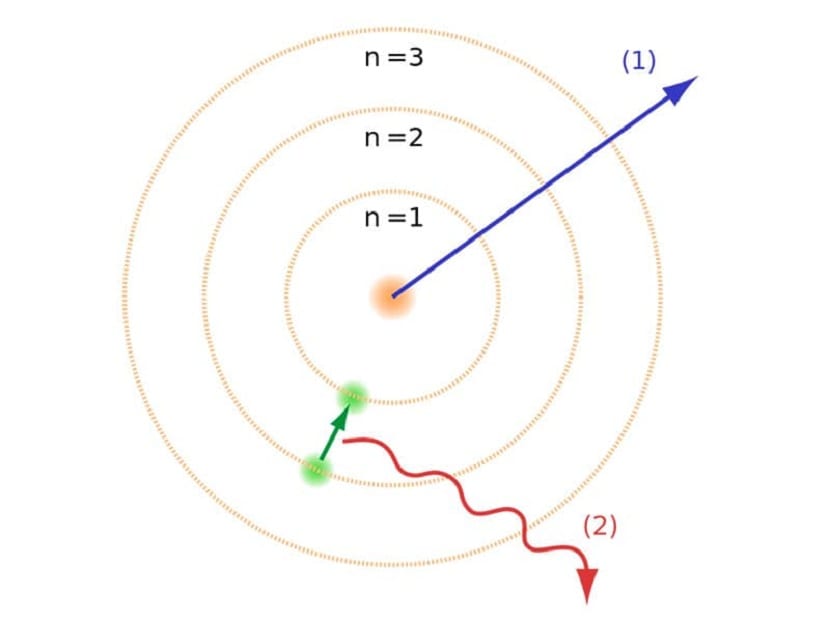
Tyto dráhy, které jsme zmínili, kde se pohybují elektrony, se nazývaly energetické vrstvy nebo energetické úrovně. To znamená, že energie, kterou mají elektrony, není vždy stejná, ale je kvantována. Kvantové hladiny jsou různé dráhy, ve kterých se nacházejí atomy. Podle toho, na které oběžné dráze se v daném okamžiku nachází, bude mít více či méně energie. Oběžné dráhy blíže k jádru atomu mají větší množství energie. Na druhou stranu, čím více se vzdalují od jádra, tím méně energie.
Model energetické úrovně
Tento Bohrův atomový model, z něhož vyplývá, že elektrony mohou získávat nebo ztrácet energii pouze skokem z jedné dráhy na druhou, pomohl vyřešit kolaps navržený Rutherfordovým modelem. Při přechodu z jedné energetické úrovně na druhou absorbuje nebo emituje elektromagnetické záření. To znamená, že když skočíte z více nabité energie na méně nabitou, uvolníte přebytečnou energii. Naopak, když přechází z nízké energetické úrovně na vyšší, absorbuje elektromagnetické záření.
Protože tento atomový model je modifikací Rutherfordova modelu, jsou zachovány vlastnosti malého centrálního jádra a většiny hmotnosti atomu. Přestože oběžné dráhy elektronů nejsou ploché jako oběžné dráhy planet, dalo by se říci, že tyto elektrony rotují kolem svého jádra podobným způsobem jako planety kolem Slunce.
Bohrovy principy atomového modelu

Nyní budeme analyzovat principy tohoto atomového modelu. Jde o podrobné vysvětlení uvedeného modelu a jeho fungování.
- Částice, které mají kladný náboj Jsou v nízké koncentraci ve srovnání s celkovým objemem atomu.
- Elektrony se záporným elektrickým nábojem jsou ty, které se otáčejí kolem jádra v kruhových drahách energie.
- Existují energetické úrovně oběžných drah, kterými elektrony cirkulují. Mají také nastavenou velikost, takže mezi oběžnými drahami není žádný přechodný stav. Prostě jdou z jedné úrovně do druhé.
- Energie, kterou každá orbita vlastní, souvisí s její velikostí. Čím dále je oběžná dráha od jádra atomu, tím více energie má.
- Hladiny energie mají různý počet elektronů. Čím nižší je energetická úroveň, tím méně elektronů obsahuje. Pokud jsme například na první úrovni, budou tam až dva elektrony. Na úrovni 2 může být až 8 elektronů atd.
- Když se elektrony pohybují z jedné oběžné dráhy na druhou, absorbují nebo uvolňují elektromagnetickou energii. Pokud přejdete z jedné více energetické úrovně na druhou méně, uvolníte přebytečnou energii a naopak.
Tento model byl revoluční a snažil se poskytnout stabilitu materiálu, který předchozí modely neměly. Diskrétní emisní a absorpční spektra plynů byla vysvětlena také na tomto atomovém modelu. Byl to první model, který představil koncept kvantizace nebo kvantování. Díky tomu je Bohrův atomový model modelem, který je na půli cesty mezi klasickou mechanikou a kvantovou mechanikou. I když má také nedostatky, byl předchůdcem modelu pro pozdější kvantovou mechaniku Schrödingera a dalších vědců.
Omezení a chyby Bohrova atomového modelu
Jak jsme již zmínili, tento model má také určité nedostatky a chyby. Nejprve nevysvětluje ani neuvádí důvody, proč se elektrony musí omezovat pouze na konkrétní oběžné dráhy. Přímo předpokládá, že elektrony mají známý poloměr a oběžnou dráhu. Není tomu však tak. O deset let později Heisenbergův princip nejistoty to vyvrátil.
Ačkoli tento atomový model dokázal modelovat chování elektronů v atomech vodíku, nebyl tak přesný, pokud jde o prvky s vyšším počtem elektronů. Je to model, který má potíže s vysvětlením Zeemanova efektu. Tento efekt lze vidět, když jsou spektrální čáry rozděleny na dvě nebo více v přítomnosti vnějšího a statického magnetického pole.
Další z chyb a omezení tohoto modelu je, že poskytuje nesprávnou hodnotu momentu hybnosti oběžné dráhy základního stavu. Všechny zmíněné chyby a omezení způsobují, že Bohrův atomový model byl po letech nahrazen kvantovou teorií.
Doufám, že se v tomto článku dozvíte více o Bohrově atomovém modelu a jeho aplikacích ve vědě.