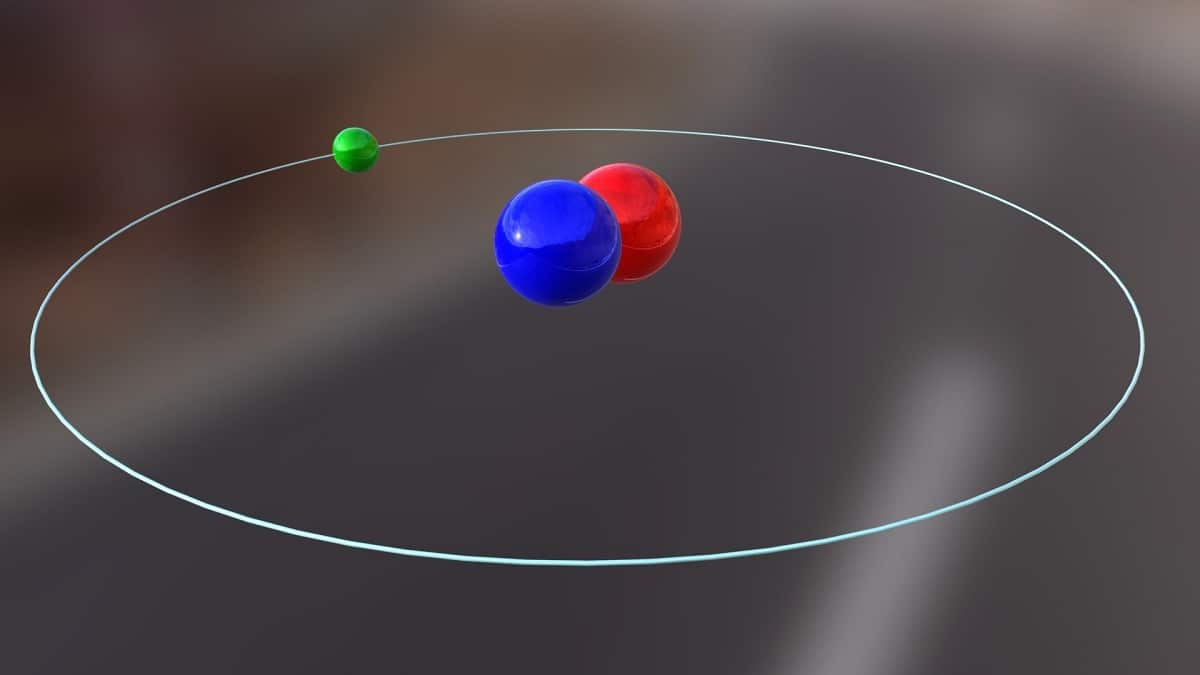
Danas ćemo razgovarati o izotopu koji se koristi za proizvodnju nuklearne energije. Radi se o deuterij. Jedna je od izotopskih vrsta vodonika i predstavljena je simbolom D ili 2H. Dobio je zajednički naziv teški vodonik jer je masa dvostruko veća od protona. Izotop nije ništa drugo do vrsta koja dolazi iz istog hemijskog elementa, ali ima drugačiji maseni broj. Deuterij se koristi u razne svrhe.
Iz tog razloga posvetit ćemo vam ovaj članak da bismo vam ispričali sve karakteristike, strukturu, svojstva i upotrebu deuterija.
Glavne karakteristike
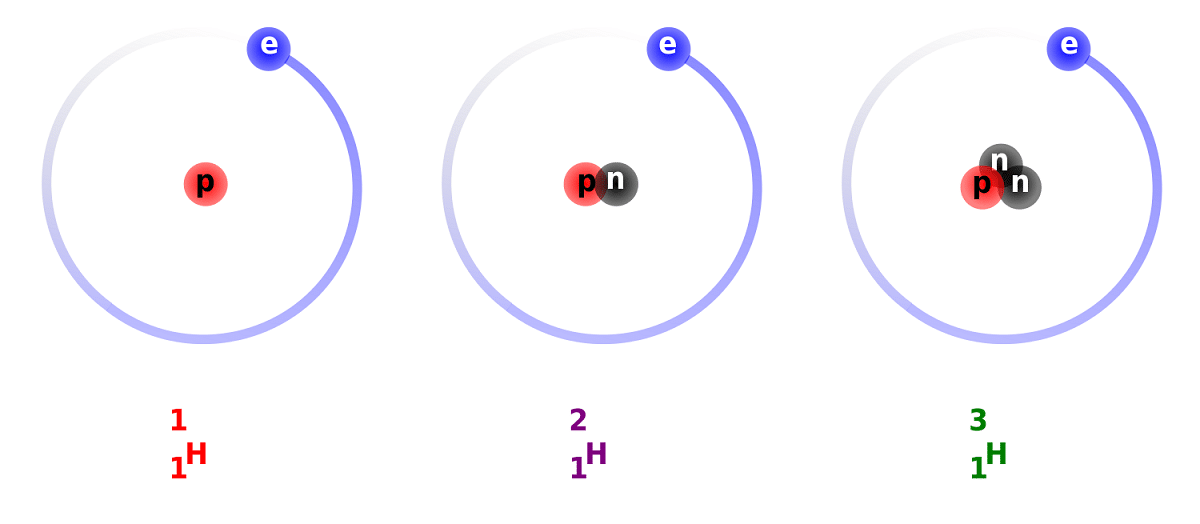
Razlika između deuterija i vodonika nastaje zbog razlike u broju neutrona koje ima. Iz tog razloga, deuterij se smatra stabilnim izotopom i može se naći u spojevima formiranim od vodonika potpuno prirodnog porijekla. Mora se uzeti u obzir da se, iako su prirodnog porijekla, javljaju u malom omjeru. S obzirom na svojstva koja ima toliko slična običnom vodiku, može ga u cijelosti zamijeniti u reakcijama u kojima sudjeluje. Na taj se način može pretvoriti u ekvivalentne supstance.
Iz ovog i drugih razloga, deuterij ima veliki broj primjena u različitim područjima nauke. Tokom godina postao je jedan od najvažnijih elemenata za istraživanje i napredak u tehnologiji i informacijama.
Glavnu strukturu ovog izotopa čini jezgra koja ima proton i neutron. Ima atomsku težinu od otprilike 2,014 grama. Ovaj izotop otkriven je zahvaljujući Haroldu C. Ureyu, kemičaru iz Sjedinjenih Država, i njegovim suradnicima Ferdinandu Brickweddeu i Georgeu Murphyju 1931. Priprema za susret deuterija u čistom stanju uspješno je prvi put izvedena 1933. godine. Već je pedesetih godina 50. stoljeća počela da se koristi čvrsta faza koja je pokazala veliku stabilnost poznata kao litijum deuterid. Ova supstanca bi mogla zamijeniti deuterij i tritij u velikom broju hemijskih reakcija.
Napredak u znanosti dolazi kada se pronađe supstanca koja može olakšati hemijske reakcije za stvaranje proizvoda. U tom smislu, ako biste proučavali obilje ovog izotopa da biste mogli posmatrati određene stvari. Poznato je da udio deuterija u vodi neznatno varira ovisno o području na kojem se uzima uzorak. Postoje neke studije spektroskopije koje su utvrdili postojanje ovog izotopa na drugim planetama u našoj galaksiji. Ovo može biti od velike važnosti za proučavanje sastava drugih nebeskih tijela.
Struktura i porijeklo deuterija

Saznat ćemo neke činjenice o deuterijumu. Kao što smo već spomenuli, glavna razlika između izotopa vodonika leži u njihovoj strukturi. A je li to što vodonik, deuterijum i tritijum imaju različite količine protona i neutrona, pa imaju različita hemijska svojstva. Takođe moram imati na umu da se deuterij koji postoji unutar drugih zvjezdanih tijela eliminira velikom brzinom nego što je nastao. To je jedan od razloga zašto je tako teško proučavati prisustvo deuterija u zvezdanim tijelima.
Smatra se da drugi fenomeni prirode stvaraju sićušnu količinu deuterija, pa njegova proizvodnja i danas izaziva znatan interes. Od procenta koji smo ranije spomenuli o prisustvu deuterija u prirodi, ne iznosi 0.02%. Niz naučnih istraživanja otkrio je da je velika većina atoma nastalih iz deuterija prirodno nastala u eksploziji koja je dovela do nastanka svemira poznatog kao Veliki prasak. To su jedan od glavnih razloga zbog kojih se smatra da je deuterij prisutan na velikim planetama poput Jupitera.
Najčešći način da se ovaj izotop dobije prirodnim putem je kada se kombiniraju s vodikom. Kada se to dogodi, kombinirat će se u obliku protivuma. Naučnike zanima saznanje o odnosu uspostavljenom između udjela deuterij i vodonik u različitim poljima nauke. Široko se proučava u granama nauke poput astronomije ili klimatologije. U tim granama ima nekoliko praktičnih programa za poznavanje i razumijevanje svemira i naše atmosfere.
Svojstva deuterija

Znat ćemo koja su glavna svojstva ovog izotopa koji pripada vodiku. Prvo je znati šta je izotop lišen radioaktivnih karakteristika. To znači da je prilično stabilne prirode. Može se koristiti za zamjenu vodika u raznim kemijskim reakcijama. Imajući veliku stabilnost prirodno, pokazuje drugačije ponašanje od običnog vodonika. To se događa u svim reakcijama koje imaju biohemijsku prirodu. Prije zamjene potrebno je znati da, iako se to može postići zamjenom vodika za deuterij u kemijskim reakcijama, mora se znati da će se oni ponašati drugačije.
Kada se zamijene dva atoma vodonika u vodi, može se dobiti spoj poznat kao teška voda. Vodik koji je prisutan u okeanu i u obliku je deuterija ima samo 0,016% u odnosu na protiv. U svemiru ovaj izotop ima tendenciju bržeg stapanja i stvaranja helija. Ako kombiniramo deuterij s atomskim kisikom, vidimo da on postaje otrovna vrsta. Uprkos tome, i hemijska svojstva ili vrlo slična svojstvima vodika.
Još jedno od svojstava ovog izotopa je da kada se atomi deuterija podvrgnu procesu nuklearne fuzije na visokim temperaturama, mogu se osloboditi velike količine energije. To je egzodus, vi ste proučavali da biste mogli usaditi nuklearnu fuziju naše planete. Neka fizička svojstva poput tačke ključanja, toplote isparavanja, trostruke tačke i gustine imaju magnitude veće od vodonika.
Nadam se da ćete s ovim informacijama saznati više o deuterijumu i njegovim karakteristikama.