
الذرة هي الوحدة الأساسية للمادة وهي أصغر جزء يمكنه تحديد عنصر كيميائي. يتكون من نواة ذرية تحتوي على نيوترونات وبروتونات وإلكترونات تحيط بالنواة. مصطلح الذرة مشتق من اليونانية ويعني غير قابل للتجزئة. ومع ذلك ، كثير من الناس لا يعرفون جيدا ما هي الذرة ولا ما هي خصائصه.
لذلك ، سنخصص هذا المقال لنخبرك ما هي الذرة وخصائصها وأهميتها.
ما هي الذرة

تتكون الذرات من جزء مركزي يسمى النواة ، حيث توجد البروتونات (الجسيمات المشحونة إيجابياً) والنيوترونات (الجسيمات المحايدة كهربائياً). المنطقة المحيطة بالنواة تحتلها الإلكترونات (جسيمات سالبة الشحنة) ؛ هذه المنطقة تسمى الطبقة الكهربائية. الغلاف الكهربائي (سالب الشحنة) والقلب (موجب الشحنة) متصلان ببعضهما البعض عن طريق التجاذب الكهربائي.
يبلغ متوسط قطر الذرة حوالي 10-10 أمتار ، ويبلغ متوسط قطر النواة حوالي 10-15 مترًا ؛ لذا، يبلغ قطر الذرة من 10.000 إلى 100.000 مرة أكبر من نواتها. على سبيل المثال ، إذا كانت الذرة بحجم ملعب كرة قدم ، فستكون النواة بنفس حجم الكرة في وسط الحقل. إذا كان قطر الذرة 100 متر ، فإن نواتها يبلغ قطرها سنتيمترًا واحدًا.
بعض التاريخ

حاول الفيلسوف اليوناني أرسطو (384 قبل الميلاد - 322 قبل الميلاد) شرح تركيب كل المادة من العناصر: الأرض والهواء والنار والماء. كان ديموقريطوس (546 قبل الميلاد - 460 قبل الميلاد) عالمًا وعالم رياضيات يونانيًا اقترح فكرة أن هناك حدًا لحجم الجسيمات. قال إن هذه الجسيمات تصبح صغيرة جدًا بحيث لا يمكن تقسيمها بعد الآن. أطلق على هذه الجسيمات اسم "الذرات".
بالنسبة لمعظم القرن التاسع عشر ، كان النموذج الذري للعالم البريطاني دالتون هو الذي اقترح النظرية الذرية ، والتي كانت أبعد من تفكير القدماء في ذلك الوقت.
هذه النظرية تقول ذلك تتكون كل المواد من جسيمات صغيرة غير قابلة للتجزئة تسمى الذرات. وجدت الأبحاث الحديثة أن الذرات تتكون من جسيمات صغيرة أخرى تسمى الجسيمات دون الذرية.
تاريخيًا ، تم تطوير نظريات ذرية مختلفة حول تكوين المادة قبل الحصول على المعرفة الحالية حول التركيب الذري. بناءً على النظرية الذرية ، كان العلماء يبرهنون على نماذج الذرات المتطورة تدريجياً.
تم تطوير النموذج الأول الذي اقترحه جون دالتون ليصبح نموذج نيلز بور للذرة. اقترح بور نموذجًا مشابهًا جدًا للنموذج الحالي للإلكترونات التي تدور حول النواة.
هيكل الذرة
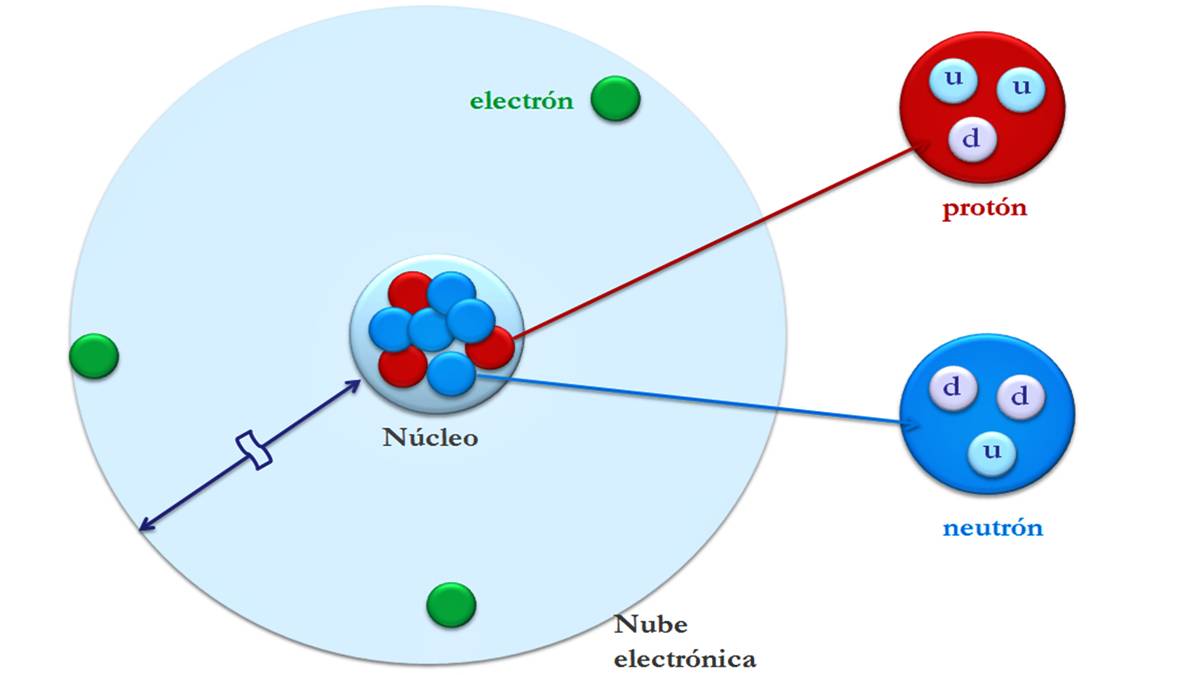
تتكون الذرات من جسيمات صغيرة تسمى الجسيمات دون الذرية: الإلكترونات والبروتونات والنيوترونات. تتركز معظم كتلة الذرة في النواة. ويكون الحجم الأكبر في الغلاف الكهربائي حيث توجد الإلكترونات.
الإلكترونات والبروتونات والنيوترونات
الإلكترونات سالبة الشحنة وليس لها كتلة تقريبًا. تبلغ كتلته حوالي 1840 ضعف كتلة النواة الذرية.. إنها جسيمات صغيرة تدور حول النواة المركزية للذرة. بالإضافة إلى ذلك ، فإنها تتحرك بسرعة حول النواة لتوليد مجال كهرومغناطيسي.
للبروتون نفس الشحنة الموجبة مثل شحنة الإلكترون في القيمة المطلقة ، لذلك تميل البروتونات والإلكترونات إلى جذب بعضهما البعض. تشكل هذه وحدة الكتلة وتشكل مع النيوترونات نواة الذرة.
النيوترونات ليس لها شحنة ، أي أن لديها شحنة متعادلة. جنبا إلى جنب مع البروتونات ، تشكل النواة وتمثل تقريباً كل كتلة الذرة (99,9٪). توفر النيوترونات الاستقرار للنواة.
تحتوي الذرات على مستويات طاقة ، سبع قذائف حول النواة توجد بها إلكترونات تدور حول النواة. يُطلق على الأصداف اسم K و L و M و N و O و P و Q. يمكن أن تحتوي كل قذيفة على عدد محدود من الإلكترونات: ثمانية إلكترونات لكل غلاف. دائمًا ما تكون الطبقة الخارجية هي الأكثر ديناميكية. فقط ذرة الهيدروجين لا تحتوي على نيوترونات ويدور إلكترون واحد فقط حول البروتون.
الخصائص الكيميائية
في الكيمياء ، الذرات هي الوحدات الأساسية التي عادة ما تحتفظ بخصائصها الأصلية في كل تفاعل. لم يتم تدميرها أو إنشاؤها ، بل يتم ترتيبها ببساطة بطرق مختلفة مع روابط مختلفة فيما بينها.
تتجمع الذرات معًا لتكوين جزيئات وأنواع أخرى من المواد. الروابط التي تنشأ في التفاعلات الكيميائية لها تركيبة معينة تميز العناصر الكيميائية المختلفة. هذه العناصر هي تلك التي تظهر في الجدول الدوري للعناصر.
يحتوي كل عنصر من هذه العناصر على العديد من البروتونات في النواة. يُطلق على هذا الرقم الرقم الذري ويُشار إليه بالحرف Z. جميع الذرات التي لها نفس العدد من البروتونات تنتمي إلى نفس العنصر ولها نفس الخصائص الكيميائية على الرغم من أنها عناصر كيميائية مختلفة.
وعلاوة على ذلك، نجد العدد الكتلي ، والمشار إليه بالحرف أ. يشير هذا الرقم إلى عدد النكليونات الموجودة في الذرة. هناك نوع آخر من الذرات يمكننا إيجاده ، ونعرف عنه أفضل ما هو نظير. هذه الذرات لها نفس عدد البروتونات ولكن أعداد مختلفة من النيوترونات. لديهم نفس الخصائص الكيميائية على الرغم من أن خصائصهم الفيزيائية تختلف عن بعضها البعض.
كما أشرنا سابقًا ، فإن النظائر مهمة جدًا. وهي حيوية للطاقة النووية لأن تخصيب اليورانيوم يتضمن تحويل أحد نظائر اليورانيوم إلى نظير آخر بهيكل كيميائي غير مستقر ، مما يسمح لنا بالحصول على تفاعل متسلسل.
خصائص
الخصائص التي تحدد الذرة هي:
- الرقم الذري (Z) يشير إلى عدد البروتونات في النواة. تنتمي جميع الذرات التي لها نفس عدد البروتونات إلى نفس العنصر. على سبيل المثال ، ذرة هيدروجين بها بروتون واحد فقط.
- يشير العدد الكتلي إلى مجموع البروتونات والنيوترونات.. العناصر ذات الأعداد المختلفة من النيوترونات هي نظائر مختلفة لنفس العنصر.
- كهرسلبية إنه ميل الذرات لجذب الإلكترونات عندما تشكل روابط كيميائية.
- نصف القطر الذري إنها تقابل نصف المسافة بين نواتين متصلين من نفس العنصر.
- إمكانية التأين إنها الطاقة اللازمة لإزالة الإلكترون من عنصر.
آمل أن تتمكن من خلال هذه المعلومات من معرفة المزيد عن ماهية الذرة وخصائصها.
جيد جدا
RICARDO